Natri hiđrua (NaH2O) và natri hiđroxit (NaOH) là hai hợp chất vô cơ có nhiều ứng dụng trong đời sống và sản xuất công nghiệp. Việc cân bằng phương trình hóa học của các phản ứng liên quan đến hai hợp chất này rất quan trọng để hiểu cơ chế phản ứng và định lượng chính xác các chất phản ứng và sản phẩm.
Phản ứng của NaH2O với nước
NaH2O và phản ứng của nó với nước
Natri hiđrua (NaH2O) là một hợp chất vô cơ có phản ứng cao. Khi tiếp xúc với nước, NaH2O phản ứng mạnh tạo thành natri hiđroxit (NaOH) và giải phóng khí hiđro theo phương trình hóa học cân bằng:
NaH2O + H2O → NaOH + H2
Trong phản ứng này, NaH2O đóng vai trò là chất khử, trải qua quá trình oxy hóa để tạo ra khí hydro. Ngược lại, nước đóng vai trò là chất oxy hóa, cung cấp oxy để tạo thành natri hiđroxit (NaOH).
Bảng cân đối phản ứng
| Người tham gia | Hệ số | Chất lượng sản phẩm | Hệ số |
|---|---|---|---|
| NaH2O | 1 | NaOH | 1 |
| Nước | 1 | H2 | 1 |
Ý nghĩa của phản ứng cân bằng
Phản ứng cân bằng của NaH2O với nước cho thấy tỷ lệ mol giữa các chất phản ứng và sản phẩm, đảm bảo tuân thủ định luật bảo toàn khối lượng. Điều này cho phép chúng ta tính toán chính xác khối lượng hoặc thể tích của các chất trong phản ứng, cũng như dự đoán tính chất hóa học của các chất phản ứng và sản phẩm.
Phản ứng của NaOH với axit
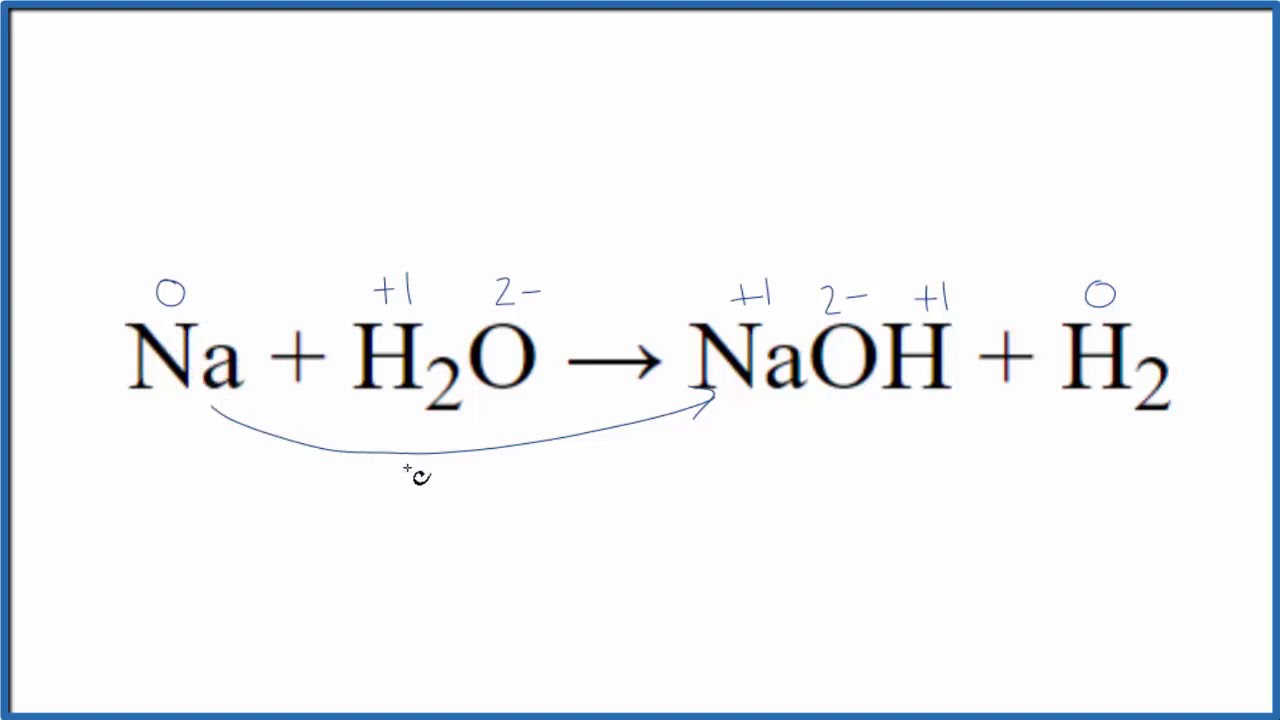
NaOH và bản chất phản ứng của nó với axit
Natri hiđroxit (NaOH) là một bazơ mạnh phản ứng với axit tạo thành muối và nước. Phương trình hóa học cân bằng cho phản ứng này được thể hiện dưới đây:
NaOH + HCl → NaCl + H2O
Trong phản ứng này, NaOH đóng vai trò là chất phản ứng, kết hợp với axit clohydric (HCl) để tạo thành muối natri clorua (NaCl) và nước (H2O).
Bảng cân đối phản ứng
| Người tham gia | Hệ số | Chất lượng sản phẩm | Hệ số |
|---|---|---|---|
| NaOH | 1 | NaCl | 1 |
| HCl | 1 | Nước | 1 |
Ý nghĩa của phản ứng cân bằng
Tương tự như phản ứng của NaH2O với nước, phản ứng cân bằng của NaOH với axit giúp chúng ta hiểu được tỷ lệ mol giữa các chất và dự đoán khối lượng hoặc thể tích của chất phản ứng và sản phẩm. Điều này rất quan trọng trong việc định lượng các phản ứng hóa học và ứng dụng của chúng trong thực tế.
Ứng dụng của NaH2O và NaOH
Ứng dụng của NaH2O
- Là chất khử trong nhiều phản ứng hóa học.
- Được sử dụng trong sản xuất thủy tinh.
- Dùng làm chất thông cống.
Ứng dụng của NaOH
- Được sử dụng như chất tẩy rửa trong các sản phẩm vệ sinh cá nhân và gia dụng.
- Được sử dụng trong sản xuất xà phòng và giấy.
- Được tìm thấy trong các ứng dụng pin nhiên liệu và điện phân.
Vai trò của việc cân bằng phương trình hóa học
Việc cân bằng phương trình hóa học rất quan trọng vì nó cho phép chúng ta:
- Đảm bảo số nguyên tử của mỗi nguyên tố ở vế trái của phương trình đã cân bằng bằng số nguyên tử của nguyên tố đó ở vế phải của phương trình.
- Xác định tỉ lệ mol chính xác của chất phản ứng và sản phẩm tạo thành.
- Dự đoán khối lượng và thể tích của chất phản ứng và sản phẩm tạo thành.
Kết luận
Phương trình hóa học cân bằng của NaH2O và NaOH cung cấp thông tin quan trọng về cơ chế phản ứng và tỷ lệ mol giữa chất phản ứng và sản phẩm. Cân bằng phương trình hóa học rất quan trọng để hiểu các phản ứng hóa học và áp dụng chúng hiệu quả trong cuộc sống thực.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














