Phản ứng hóa học giữa clo (Cl2) và nước (H2O) là một phản ứng quan trọng trong nhiều lĩnh vực, bao gồm công nghiệp hóa chất, xử lý nước và nghiên cứu khoa học. Phản ứng này tạo ra hai sản phẩm chính: axit clohydric (HCl) và axit hipoclorơ (HClO). Hiểu được quá trình này, bao gồm vai trò của các chất phản ứng, điều kiện phản ứng và cơ chế hóa học, có thể giúp chúng ta tối ưu hóa quá trình và áp dụng phản ứng một cách hiệu quả.
Vai trò của Cl2 trong phản ứng
Clo (Cl2) là một loại khí màu vàng lục được tạo ra từ quá trình điện phân muối. Khi phản ứng với nước, clo hoạt động như một chất oxy hóa mạnh, cho phép hình thành các sản phẩm như axit clohydric và axit hipoclorơ.
Clo có cấu hình electron ở trạng thái cơ bản là [Ne] 3s^2 3p^5, có hai electron không ghép đôi trong lớp 3p. Do đó, clo rất ưa electron và có xu hướng tham gia các phản ứng oxy hóa khử. Khi tham gia phản ứng với nước, clo sẽ bị khử và mất electron, biến thành ion clorua (Cl-).
Ngoài ra, clo còn có khả năng tham gia phản ứng thế với hydro trong phân tử nước tạo thành các sản phẩm như axit clohydric và axit hipoclorơ.
Tính chất và cấu trúc của Cl2
Clo là nguyên tố hóa học thuộc nhóm 17 (nhóm halogen) của bảng tuần hoàn. Trong điều kiện bình thường, clo tồn tại dưới dạng phân tử hai nguyên tử Cl2, có các đặc điểm sau:
- Cấu hình electron: [Ne] 3s^2 3p^5
- Số oxi hóa: 0 (trong phân tử Cl2)
- Liên kết cộng hóa trị giữa hai nguyên tử clo: Liên kết đơn
- Độ âm điện: 3,16 (trên thang Pauling)
- Khối lượng phân tử: 70,9 g/mol
Clo là một loại khí màu vàng lục ở nhiệt độ phòng có mùi khó chịu đặc trưng. Clo rất độc và gây kích ứng mắt, đường hô hấp và da. Do đó, phải thực hiện các biện pháp phòng ngừa an toàn khi sử dụng clo.
Tính chất hóa học của Cl2
Clo là chất oxy hóa mạnh, có khả năng tham gia nhiều phản ứng hóa học. Một số tính chất hóa học điển hình của clo bao gồm:
- Phản ứng với kim loại: Clo có thể phản ứng với nhiều kim loại như sắt, nhôm, đồng tạo thành muối halogen tương ứng. Ví dụ: 2Na + Cl2 → 2NaCl
- Phản ứng với hiđro: Clo có thể phản ứng với hiđro tạo thành axit clohiđric (HCl). Ví dụ: H2 + Cl2 → 2HCl
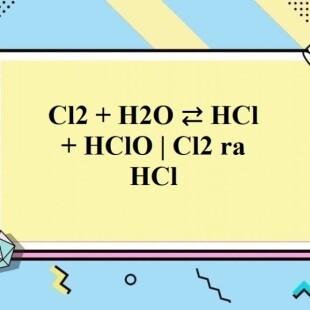
- Phản ứng với nước: Clo có thể phản ứng với nước tạo thành axit clohydric (HCl) và axit hipoclorơ (HClO). Ví dụ: Cl2 + H2O → HCl + HClO
- Phản ứng oxi hóa – khử: Do có tính oxi hóa mạnh nên clo có thể tham gia nhiều phản ứng oxi hóa – khử như oxi hóa các chất hữu cơ, tẩy trắng và khử các hợp chất.
Khi phản ứng với nước, clo đóng vai trò là chất oxy hóa, cho phép các quá trình hình thành axit clohydric và axit hipoclorơ diễn ra.
Vai trò của H2O trong phản ứng
Nước (H2O) là hợp chất có công thức phân tử H2O, được tạo thành từ hai nguyên tử hydro và một nguyên tử oxy, liên kết với nhau bằng liên kết cộng hóa trị. Nước đóng vai trò quan trọng trong phản ứng giữa clo (Cl2) và nước, cung cấp chất phản ứng và điều kiện để phản ứng diễn ra.
Trong phản ứng Cl2 + H2O → HCl + HClO, nước đóng vai trò là chất phản ứng, cung cấp nguyên tử hydro và ion hydroxide để tạo thành sản phẩm. Ngoài ra, nước cũng cung cấp môi trường phản ứng, đóng vai trò là dung môi.
Cấu trúc và tính chất của H2O
Nước (H2O) là một hợp chất vô cơ có cấu trúc và tính chất sau:
- Cấu hình electron: 1s^2 2s^2 2p^4
- Số oxi hóa: -2
- Liên kết cộng hóa trị: Liên kết đôi giữa oxy và hydro
- Góc liên kết HOH: 104,5°
- Dạng vật lý: Chất lỏng ở nhiệt độ phòng
- Điểm sôi: 100°C
- Nhiệt độ đóng băng: 0°C
- Chất điện phân: Phân cực, có thể tạo thành ion H+ và OH-
Nước là chất lỏng không màu, không mùi, không vị ở nhiệt độ và áp suất bình thường. Đây là chất phân cực, có khả năng hình thành liên kết hydro, tạo ra các tính chất đặc trưng như độ nhớt cao và nhiệt dung lớn.
Trong phản ứng với clo, nước cung cấp các nguyên tử hydro và ion hydroxide để tạo thành axit clohydric và axit hipoclorơ.
Vai trò của H2O trong phản ứng Cl2 + H2O → HCl + HClO
Nước đóng vai trò quan trọng trong phản ứng giữa clo và nước, như thể hiện ở các khía cạnh sau:
- Cung cấp nguyên tử hydro (H) và ion hydroxide: Nước cung cấp nguyên tử hydro và ion hydroxide cần thiết cho quá trình hình thành axit clohydric (HCl) và axit hipoclorơ (HClO).
- Tạo môi trường phản ứng: Nước đóng vai trò là dung môi, tạo ra môi trường thích hợp để phản ứng giữa clo và nước diễn ra.
- Sản phẩm hòa tan: Các sản phẩm như axit clohydric và axit hipoclorơ có thể hòa tan trong nước, tạo thành dung dịch.
- Tham gia vào cơ chế phản ứng: Nước có thể tham gia trực tiếp vào cơ chế phản ứng, chẳng hạn như trong bước trung gian hình thành axit hipoclorơ.
Như vậy, nước đóng vai trò không thể thiếu trong phản ứng giữa clo và nước, cung cấp chất phản ứng, tạo môi trường thích hợp và tham gia vào cơ chế phản ứng.
Sản phẩm của phản ứng giữa Cl2 và H2O
Khi clo (Cl2) phản ứng với nước (H2O), nó tạo thành hai sản phẩm chính: axit clohydric (HCl) và axit hipoclorơ (HClO). Các sản phẩm này có vai trò và ứng dụng quan trọng trong nhiều lĩnh vực.
Axit clohydric (HCl)
Axit clohydric (HCl) là một axit vô cơ, có công thức hóa học là HCl. Nó được tạo ra trong phản ứng giữa clo và nước, theo phương trình:
Cl2 + H2O → HCl + HClO
Axit clohydric là chất lỏng không màu có mùi hăng và vị chua. Một số tính chất quan trọng của HCl bao gồm:
- Công thức hóa học: HCl
- Dạng vật lý: Chất lỏng không màu
- Điểm sôi: -85°C
- Nhiệt độ đóng băng: -114°C
- Sự phân ly chất điện giải: Một axit mạnh, phân ly hoàn toàn trong nước.
- Tính chất hóa học: Axit, phản ứng với kim loại, bazơ, muối…
Axit clohydric có nhiều ứng dụng quan trọng như trong sản xuất hóa chất, xử lý nước, công nghiệp thực phẩm, y học…
Axit hipoclorơ (HClO)
Axit hipoclorơ (HClO) là một axit yếu, có công thức hóa học là HClO. Nó cũng được tạo ra trong phản ứng giữa clo và nước, theo phương trình:
Cl2 + H2O → HCl + HClO
Axit hipoclorơ là chất lỏng không màu, có tính oxy hóa mạnh. Một số tính chất quan trọng của HClO bao gồm:
- Công thức hóa học: HClO
- Dạng vật lý: Chất lỏng không màu
- Điểm sôi: 40°C
- Nhiệt độ đóng băng: -9°C
- Phân ly chất điện giải: Axit yếu, phân ly một phần trong nước
- Tính chất hóa học: Axit, chất oxi hóa mạnh, tham gia phản ứng oxi hóa khử
Axit hipoclorơ có nhiều ứng dụng quan trọng như công nghiệp hóa chất, xử lý nước, tẩy trắng, khử trùng…
Vì vậy, phản ứng giữa clo và nước tạo ra hai sản phẩm chính: axit clohydric (HCl) và axit hipoclorơ (HClO), mỗi loại có tính chất và ứng dụng riêng.
Điều kiện phản ứng
Phản ứng giữa clo (Cl2) và nước (H2O) để tạo thành axit clohydric (HCl) và axit hipoclorơ (HClO) diễn ra trong những điều kiện nhất định. Các điều kiện quan trọng của phản ứng bao gồm:
Nhiệt độ
Phản ứng Cl2 + H2O → HCl + HClO thường diễn ra ở nhiệt độ phòng, khoảng 20-25°C. Tuy nhiên, nếu nhiệt độ quá cao, phản ứng sẽ bị chuyển hướng, tạo thành các sản phẩm khác như Cl2O và HClO3.
độ pH
Phản ứng diễn ra tốt nhất trong môi trường có tính axit, với độ pH thấp (pH
Thời gian liên lạc
Thời gian tiếp xúc giữa clo và nước cũng ảnh hưởng đến kết quả phản ứng. Thời gian tiếp xúc càng dài, phản ứng càng hoàn thiện, tạo ra nhiều sản phẩm HCl và HClO hơn.
Nồng độ của chất tham gia
Nồng độ clo (Cl2) và nước (H2O) tham gia phản ứng ảnh hưởng đến tỷ lệ sản phẩm được tạo thành. Thông thường, nồng độ clo cao sẽ làm tăng tỷ lệ HClO so với HCl.
Áp lực
Áp suất cũng là một yếu tố ảnh hưởng đến phản ứng, nhưng không đáng kể. Phản ứng thường diễn ra ở áp suất khí quyển.
Ngoài ra, việc kiểm soát và điều chỉnh các yếu tố trên sẽ giúp tối ưu hóa phản ứng giữa clo và nước, tạo ra sản phẩm mong muốn một cách hiệu quả.
Cơ chế phản ứng
Cơ chế phản ứng giữa clo (Cl2) và nước (H2O) để tạo ra axit clohydric (HCl) và axit hipoclorơ (HClO) là một quá trình phức tạp, bao gồm các bước sau:
- Bước 1: Clo (Cl2) phản ứng với nước (H2O), tạo thành axit clohydric (HCl) và axit hipoclorơ (HClO) theo phương trình sau.
- Bước 2: Axit clohydric và axit hipoclorơ hòa tan trong nước tạo thành dung dịch có tính axit.
- Bước 3: Dung dịch axit này có thể tiếp tục phản ứng với các chất khác tùy thuộc vào điều kiện cụ thể của phản ứng.
Quá trình này diễn ra trong môi trường có tính axit và sử dụng nước như một thuốc thử quan trọng, giúp tạo ra hai sản phẩm là axit clohydric và axit hipoclorơ.
Ứng dụng của phản ứng
Phản ứng giữa clo và nước để tạo ra axit clohydric và axit hipoclorơ có nhiều ứng dụng thực tế quan trọng, bao gồm:
- Khử trùng: Axit clohydric và axit hipoclorơ được sử dụng rộng rãi trong việc khử trùng nước uống, hồ bơi, bể bơi…
- Sản xuất hóa chất: Cả hai sản phẩm đều là nguyên liệu thô quan trọng để sản xuất các hợp chất hóa học khác.
- Xử lý nước: Axit clohydric và axit hipoclorơ được sử dụng trong xử lý nước thải và làm sạch nước.
- Y tế: Axit clohydric được sử dụng trong y học, ví dụ như trong quá trình tiêu hóa thức ăn.
- Ngành công nghiệp thực phẩm: Axit clohydric và axit hipoclorơ cũng được sử dụng trong ngành công nghiệp thực phẩm để làm sạch và khử trùng.
Do có tính oxy hóa, khử trùng và tính axit mạnh nên phản ứng này có nhiều ứng dụng quan trọng trong cuộc sống hàng ngày và trong nhiều ngành công nghiệp khác nhau.
Tính chất của axit clohydric (HCl) và axit hipoclorơ (HClO)
Tính chất của axit clohydric (HCl)
Axit clohydric (HCl) là một axit vô cơ có nhiều tính chất đặc trưng như sau:
Bảng so sánh tính chất của HCl
| Thiên nhiên | Axit clohydric (HCl) |
|---|---|
| Hình thức tồn tại | Chất lỏng không màu |
| Điểm sôi | -85°C |
| Điểm đóng băng | -114°C |
| Chất điện phân | Mạnh, hoàn toàn tách biệt trong nước |
| Tính chất hóa học | Axit, phản ứng với kim loại, bazơ, tạo thành muối… |
Axit clohydric được biết đến với tính axit mạnh, có khả năng tác dụng mạnh với bazơ và kim loại, tạo ra các phản ứng hóa học đặc trưng.
Tính chất của axit hipoclorơ (HClO)
Axit hipoclorơ (HClO) cũng có nhiều tính chất quan trọng, bao gồm:
Bảng so sánh tính chất của HClO
| Thiên nhiên | Axit hipoclorơ (HClO) |
|---|---|
| Hình thức tồn tại | Chất lỏng không màu |
| Điểm sôi | 40°C |
| Điểm đóng băng | -9°C |
| Độ điện giải | Yếu, phân ly một phần trong nước |
| Tính chất hóa học | Axit, chất oxy hóa mạnh… |
Axit hipoclorơ được biết đến với tính chất oxy hóa mạnh, có khả năng tác dụng lên nhiều chất khác nhau, tham gia vào các phản ứng oxy hóa khử trong nhiều ứng dụng khác nhau.
Ý nghĩa của phản ứng
Phản ứng giữa clo và nước tạo ra axit clohydric và axit hipoclorơ không chỉ là một quá trình hóa học mà còn có ý nghĩa quan trọng trong đời sống và công nghiệp. Sản phẩm của phản ứng này được sử dụng rộng rãi trong nhiều lĩnh vực, từ y học đến công nghiệp, từ xử lý nước đến sản xuất hóa chất. Việc hiểu được cơ chế và tính chất của phản ứng giữa clo và nước giúp chúng ta ứng dụng hiệu quả vào thực tế và tận dụng được các ứng dụng của nó.
Kết luận
Trong bài viết này, chúng ta đã tìm hiểu về phản ứng hóa học giữa clo và nước để tạo thành axit clohydric (HCl) và axit hipoclorơ (HClO). Chúng ta đã xem xét vai trò của clo và nước trong phản ứng, các sản phẩm của phản ứng, các điều kiện cần thiết, cơ chế phản ứng, ứng dụng, tính chất của axit clohydric và axit hipoclorơ, và ý nghĩa của phản ứng. Hy vọng rằng thông tin này sẽ giúp bạn hiểu rõ hơn về quá trình này và áp dụng vào thực tế. Cảm ơn các bạn đã theo dõi!
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














