Phản ứng giữa carbon dioxide (CO2) và canxi hydroxit (Ca(OH)2) là một ví dụ điển hình về cân bằng phản ứng hóa học. Quá trình này diễn ra trong nhiều ứng dụng thực tế, từ công nghiệp hóa học đến môi trường và sinh học. Hiểu rõ cân bằng phản ứng này sẽ giúp chúng ta nắm vững các khái niệm cơ bản về cân bằng hóa học, đồng thời ứng dụng chúng vào việc thiết kế và kiểm soát các quá trình hóa học.
Phương trình cân bằng phản ứng: Carbon dioxide và Canxi hydroxit tạo ra Canxi cacbonat và Nước
Định nghĩa và mô tả phản ứng
Phản ứng giữa carbon dioxide (CO2) và canxi hydroxit (Ca(OH)2) được biểu diễn bằng phương trình hóa học như sau:
CO2 + Ca(OH)2 → CaCO3 + H2O
Trong phản ứng này, carbon dioxide (CO2) và canxi hydroxit (Ca(OH)2) là các chất tham gia phản ứng (phản ứng chính). Sản phẩm của phản ứng là canxi cacbonat (CaCO3) và nước (H2O).
Các trạng thái và điều kiện của phản ứng
Phản ứng này thường diễn ra trong điều kiện nhiệt độ phòng và áp suất bình thường. Carbon dioxide có thể ở trạng thái khí, trong khi canxi hydroxit và canxi cacbonat thường ở trạng thái rắn. Nước có thể ở trạng thái lỏng hoặc hơi, tùy thuộc vào điều kiện nhiệt độ và áp suất.
Ứng dụng của phản ứng
Phản ứng giữa carbon dioxide và canxi hydroxit có nhiều ứng dụng quan trọng, như:
- Công nghiệp xi măng: Canxi cacbonat (CaCO3) là thành phần chính của đá vôi, một nguyên liệu quan trọng trong sản xuất xi măng.
- Xử lý nước và nước thải: Canxi hydroxit được sử dụng để điều chỉnh pH, loại bỏ kim loại nặng và các chất ô nhiễm khác trong nước và nước thải.
- Công nghiệp hóa chất: Canxi cacbonat có nhiều ứng dụng trong công nghiệp hóa chất, như sản xuất kính, sơn, nhựa và giấy.
- Môi trường: Phản ứng này điều chỉnh pH của môi trường, giúp trung hòa axit và kiềm, bảo vệ các hệ sinh thái.
- Sinh học: Canxi cacbonat là thành phần chính của vỏ sò, vỏ ốc và xương của nhiều sinh vật.
Ý nghĩa phản ứng cân bằng: Phản ứng hóa học giữa Carbon dioxide và Canxi hydroxit
Tầm quan trọng của cân bằng phản ứng
Cân bằng phản ứng là một khái niệm cơ bản trong hóa học, mô tả trạng thái cân bằng giữa các chất tham gia phản ứng và các sản phẩm. Việc hiểu và kiểm soát cân bằng phản ứng là rất quan trọng trong nhiều lĩnh vực, bao gồm:
- Công nghiệp hóa chất: Cân bằng phản ứng ảnh hưởng đến hiệu suất, năng suất và chi phí sản xuất.
- Môi trường: Cân bằng phản ứng có vai trò quan trọng trong xử lý nước thải, kiểm soát ô nhiễm và bảo vệ hệ sinh thái.
- Sinh học: Cân bằng phản ứng điều chỉnh pH, ion và các quá trình hóa học khác trong cơ thể sống.
- Hóa học phân tích: Cân bằng phản ứng là nền tảng cho các phương pháp phân tích hóa học định lượng.
Ứng dụng của cân bằng phản ứng trong thực tế
Cân bằng phản ứng giữa carbon dioxide và canxi hydroxit có nhiều ứng dụng thực tế, chẳng hạn:
- Xử lý nước và nước thải: Canxi hydroxit được sử dụng để trung hòa axit và điều chỉnh pH trong các quá trình xử lý nước.
- Công nghiệp xi măng: Phản ứng tạo ra canxi cacbonat là một bước quan trọng trong sản xuất xi măng.
- Môi trường: Phản ứng này giúp điều chỉnh pH, trung hòa axit và bảo vệ các hệ sinh thái.
- Sinh học: Canxi cacbonat là thành phần chính của vỏ sò, vỏ ốc và xương của nhiều sinh vật.
- Công nghiệp hóa chất: Canxi cacbonat có nhiều ứng dụng trong sản xuất kính, sơn, nhựa và giấy.
Hiểu rõ cân bằng phản ứng giữa carbon dioxide và canxi hydroxit sẽ giúp chúng ta kiểm soát và tối ưu hóa các quá trình liên quan, đồng thời ứng dụng chúng vào nhiều lĩnh vực khác nhau.
Cân bằng phản ứng: Định nghĩa, mục đích và các phương pháp
Định nghĩa cân bằng phản ứng
Cân bằng phản ứng là trạng thái mà tốc độ phản ứng thuận và tốc độ phản ứng nghịch bằng nhau, dẫn đến sự không thay đổi về nồng độ của các chất tham gia và sản phẩm. Ở trạng thái cân bằng, tỷ lệ các chất tham gia và sản phẩm được giữ ổn định, mặc dù phản ứng vẫn tiếp tục diễn ra.
Mục đích của cân bằng phản ứng
Mục đích chính của việc nghiên cứu cân bằng phản ứng là:
- Dự đoán và kiểm soát sự diễn biến của phản ứng hóa học.
- Tối ưu hóa các quá trình sản xuất trong công nghiệp.
- Hiểu và kiểm soát các quá trình hóa học trong môi trường và sinh học.
- Phát triển các phương pháp phân tích hóa học chính xác.
Các phương pháp cân bằng phản ứng
Có nhiều phương pháp khác nhau để nghiên cứu và xác định cân bằng phản ứng, bao gồm:
- Phương pháp nhiệt động học: Dựa trên việc tính toán các hằng số cân bằng (Kc, Kp) từ dữ liệu nhiệt động học.
- Phương pháp động học: Xác định các tốc độ phản ứng thuận và nghịch để tìm trạng thái cân bằng.
- Phương pháp thực nghiệm: Đo các thông số như nồng độ, nhiệt độ, áp suất để xác định trạng thái cân bằng.
- Phương pháp dựa trên mô hình toán học: Sử dụng các phương trình toán học để mô tả và dự đoán cân bằng phản ứng.
Việc kết hợp các phương pháp trên sẽ giúp chúng ta hiểu sâu hơn về cân bằng phản ứng, từ đó ứng dụng chúng vào thực tiễn.
Vai trò của Canxi hydroxit trong phản ứng với Carbon dioxide
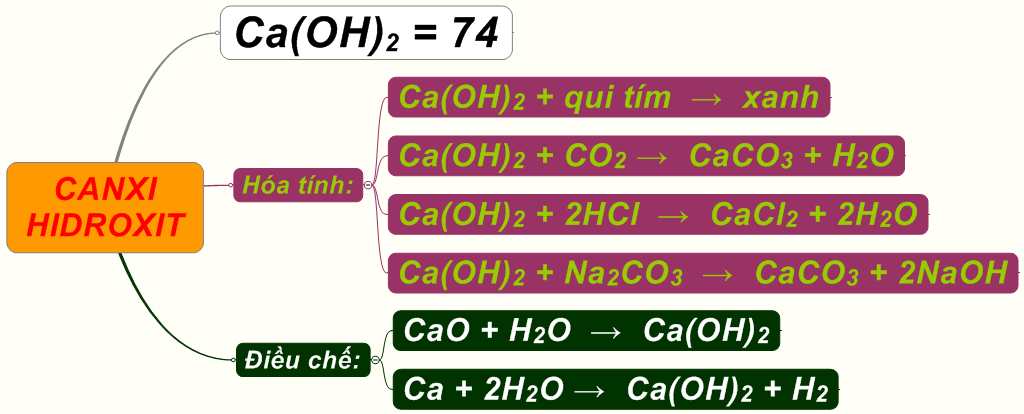
Đặc điểm và tính chất của Canxi hydroxit
Canxi hydroxit, còn được gọi là vôi sống, là một chất rắn trắng có công thức hóa học là Ca(OH)2. Một số đặc điểm và tính chất quan trọng của canxi hydroxit:
- Là một bazơ mạnh, có pH cao (khoảng 12,4).
- Tan tốt trong nước, tạo thành dung dịch kiềm.
- Tham gia nhiều phản ứng hóa học, như phản ứng trung hòa axit.
- Có khả năng hấp thụ carbon dioxide từ không khí.
Vai trò của Canxi hydroxit trong phản ứng với Carbon dioxide
Canxi hydroxit đóng vai trò quan trọng trong phản ứng với carbon dioxide, cụ thể:
- Cung cấp ion hydroxit (OH-) để trung hòa carbon dioxide, tạo ra canxi cacbonat.
- Điều chỉnh pH của môi trường, giúp duy trì môi trường kiềm.
- Là một chất hấp thụ carbon dioxide hiệu quả, được sử dụng trong nhiều ứng dụng.
- Tham gia vào quá trình karbonhóa, một bước quan trọng trong sản xuất xi măng.
Hiểu rõ vai trò của canxi hydroxit trong phản ứng với carbon dioxide sẽ giúp chúng ta kiểm soát và tối ưu hóa các quá trình liên quan.
Tầm quan trọng của phản ứng cân bằng trong phản ứng hóa học
Ứng dụng trong công nghiệp hóa chất
Cân bằng phản ứng là một khái niệm cơ bản trong công nghiệp hóa chất, ảnh hưởng trực tiếp đến hiệu suất, năng suất và chi phí sản xuất. Các nhà công nghiệp luôn cố gắng tìm ra các điều kiện tối ưu để đạt được cân bằng phản ứng có lợi nhất, như:
- Tối ưu hóa nhiệt độ, áp suất và nồng độ các chất tham gia.
- Sử dụng xúc tác để tăng tốc độ phản ứng và đạt cân bằng nhanh hơn.
- Loại bỏ hoặc thu hồi sản phẩm để đẩy phản ứng theo chiều thuận.
Vai trò trong môi trường và sinh học
Cân bằng phản ứng hóa học cũng rất quan trọng trong các hệ thống môi trường và sinh học, như:
- Điều chỉnh pH và ion trong nước, đất và cơ thể sống.
- Kiểm soát sự ô nhiễm và độc tính của các chất hóa học trong môi trường.
- Hiểu và kiểm soát các quá trình hóa sinh diễn ra trong cơ thể sống.
Việc hiểu và kiểm soát cân bằng phản ứng trong các hệ thống này sẽ giúp chúng ta bảo vệ môi trường và duy trì sự cân bằng của các hệ sinh thái.
Ứng dụng trong hóa học phân tích
Cân bằng phản ứng là nền tảng cho nhiều phương pháp phân tích hóa học định lượng, chẳng hạn:
- Chuẩn độ axit-bazơ: Dựa trên cân bằng phản ứng axit-bazơ.
- Kết tủa: Dựa trên cân bằng dung dịch-chất rắn.
- Phương pháp phân tích ion: Dựa trên cân bằng ion trong dung dịch.
Hiểu sâu về cân bằng phản ứng sẽ giúp chúng ta phát triển các phương pháp phân tích hóa học chính xác và đáng tin cậy.
Các ứng dụng của phản ứng cân bằng trong thực tế
Ứng dụng trong công nghiệp xi măng
Phản ứng giữa carbon dioxide và canxi hydroxit là một bước quan trọng trong quá trình sản xuất xi măng. Cụ thể:
- Canxi hydroxit (vôi sống) được sử dụng để phản ứng với carbon dioxide, tạo ra canxi cacbonat.
- Canxi cacbonat là thành phần chính của đá vôi, nguyên liệu quan trọng trong sản xuất xi măng.
- Quá trình karbonhóa này ảnh hưởng đến chất lượng và hiệu suất sản xuất xi măng.
Hiểu rõ cân bằng của phản ứng này sẽ giúp các nhà sản xuất xi măng kiểm soát và tối ưu hóa quá trình sản xuất.
Ứng dụng trong xử lý nước và nước thải
Phản ứng giữa carbon dioxide và canxi hydroxit còn được ứng dụng trong xử lý nước và nước thải, như:
- Canxi hydroxit được sử dụng để trung hòa axit trong nước và nước thải, giúp cân bằng pH.
- Carbon dioxide hấp thụ vào canxi hydroxit, tạo thành canxi cacbonat kết tủa, loại bỏ khí CO2 từ nước.
- Quá trình này giúp làm sạch nước và nước thải, ngăn ngừa ô nhiễm môi trường.
Việc áp dụng phản ứng cân bằng trong xử lý nước và nước thải không chỉ giúp bảo vệ môi trường mà còn tạo ra nước sạch an toàn cho sức khỏe con người.
Ứng dụng trong sản xuất thuốc và dược phẩm
Trong ngành công nghiệp dược phẩm, cân bằng phản ứng giữa carbon dioxide và canxi hydroxit cũng có ứng dụng quan trọng, như:
- Sử dụng canxi hydroxit làm chất trung hòa hoặc chất hấp thụ trong quá trình sản xuất thuốc.
- Carbon dioxide có thể được sử dụng để điều chỉnh pH của dung dịch hoặc tạo ra các sản phẩm tương tác với canxi hydroxit.
- Việc kiểm soát cân bằng phản ứng giữa hai chất này giúp đảm bảo chất lượng và hiệu suất sản xuất thuốc.
Những ứng dụng này chỉ là một phần nhỏ của việc áp dụng cân bằng phản ứng trong thực tế, cho thấy tầm quan trọng và đa dạng của khái niệm này trong nhiều lĩnh vực khác nhau.
Các yếu tố ảnh hưởng đến cân bằng phản ứng
Cân bằng phản ứng không chỉ phụ thuộc vào các chất tham gia mà còn bị ảnh hưởng bởi nhiều yếu tố khác nhau, bao gồm:
Nhiệt độ
Nhiệt độ là một yếu tố quan trọng ảnh hưởng đến cân bằng phản ứng. Thay đổi nhiệt độ có thể làm thay đổi hằng số cân bằng và tốc độ phản ứng, ảnh hưởng đến việc đạt được trạng thái cân bằng.
Áp suất
Áp suất cũng có thể ảnh hưởng đến cân bằng phản ứng, đặc biệt là đối với các phản ứng khí. Thay đổi áp suất có thể làm thay đổi cân bằng giữa các dạng chất khí và dung dịch.
Nồng độ chất tham gia
Nồng độ các chất tham gia cũng đóng vai trò quan trọng trong cân bằng phản ứng. Thay đổi nồng độ có thể ảnh hưởng đến hằng số cân bằng và đạt được trạng thái cân bằng mong muốn.
Xúc tác
Sự hiện diện của xúc tác có thể tăng tốc độ phản ứng và giúp đạt cân bằng nhanh hơn. Xúc tác thường làm thay đổi cơ chế phản ứng và giảm năng lượng cần thiết cho phản ứng diễn ra.
Môi trường phản ứng
Môi trường phản ứng, bao gồm pH, dung môi và điều kiện khác, cũng ảnh hưởng đến cân bằng phản ứng. Việc điều chỉnh môi trường phản ứng có thể làm thay đổi cơ chế và tốc độ phản ứng.
Việc hiểu và điều chỉnh những yếu tố này sẽ giúp chúng ta kiểm soát và tối ưu hóa cân bằng phản ứng theo ý muốn.
Cân bằng phản ứng Oxi hóa – Khử
Cân bằng phản ứng oxi hóa – khử là một khái niệm quan trọng trong hóa học, đặc biệt là trong các phản ứng redox. Cân bằng này xảy ra khi số electron mất đi (oxi hóa) bằng số electron nhận thêm (khử), duy trì tổng số electron không đổi.
Định nghĩa
Phản ứng oxi hóa xảy ra khi một chất mất electron, tăng số oxy hóa. Phản ứng khử xảy ra khi một chất nhận electron, giảm số oxy hóa. Cân bằng phản ứng oxi hóa – khử xảy ra khi tổng số electron mất đi bằng tổng số electron nhận thêm.
Ví dụ
Một ví dụ phổ biến về cân bằng phản ứng oxi hóa – khử là phản ứng giữa Fe2+ và MnO4- trong môi trường axit:
[5Fe^ + 4H2O]Trong phản ứng này, Fe2+ bị oxi hóa thành Fe3+ và MnO4- bị khử thành Mn2+, duy trì tổng số electron không đổi.
Ứng dụng
Cân bằng phản ứng oxi hóa – khử có nhiều ứng dụng trong thực tế, như trong quá trình điện phân, sản xuất điện, xử lý nước và nước thải. Hiểu và kiểm soát cân bằng phản ứng này giúp chúng ta áp dụng hiệu quả trong nhiều lĩnh vực khác nhau.
Cân bằng phản ứng axit – bazơ
Cân bằng phản ứng axit – bazơ là một khái niệm quan trọng trong hóa học, đặc biệt là trong quá trình trung hòa axit và bazơ. Cân bằng này xảy ra khi số proton mất đi (axit) bằng số proton nhận thêm (bazơ), duy trì tổng số proton không đổi.
Định nghĩa
Phản ứng axit xảy ra khi một chất nhả proton, tăng số axit. Phản ứng bazơ xảy ra khi một chất nhận proton, giảm số axit. Cân bằng phản ứng axit – bazơ xảy ra khi tổng số proton nhả đi bằng tổng số proton nhận thêm.
Ví dụ
Một ví dụ phổ biến về cân bằng phản ứng axit – bazơ là phản ứng giữa HCl và NaOH:
[HCl + NaOH \rightarrow NaCl + H2O]Trong phản ứng này, HCl là axit, NaOH là bazơ, và sau phản ứng, tổng số proton không đổi.
Ứng dụng
Cân bằng phản ứng axit – bazơ có ứng dụng rộng rãi trong thực tế, như trong quá trình chuẩn độ axit-bazơ, điều chỉnh pH trong nước và nước thải, và trong quá trình sản xuất hóa chất. Hiểu và kiểm soát cân bằng phản ứng này giúp chúng ta áp dụng hiệu quả trong nhiều lĩnh vực khác nhau.
Kết luận
Trên đây là một số thông tin cơ bản về cân bằng phản ứng, vai trò của canxi hydroxit trong phản ứng với carbon dioxide, tầm quan trọng của phản ứng cân bằng trong hóa học, các ứng dụng thực tế, yếu tố ảnh hưởng và các phương pháp cân bằng phản ứng. Hiểu sâu về các khái niệm này không chỉ giúp chúng ta nắm vững kiến thức hóa học mà còn áp dụng vào thực tiễn một cách hiệu quả. Mong rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan về chủ đề này. Xin cảm ơn!
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 09633458xxx hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














