Sắt là một trong những nguyên tố kim loại phổ biến nhất trên Trái Đất. Trong môi trường tự nhiên, sắt thường tồn tại dưới dạng ion sắt (II) hoặc sắt (III), tùy thuộc vào điều kiện oxy hóa khử. Một quá trình quan trọng liên quan đến sắt là quá trình chuyển đổi ion sắt (II) thành ion sắt (III) thông qua phản ứng oxy hóa. Phản ứng này quan trọng trong nhiều lĩnh vực, từ địa chất, hóa học, công nghiệp đến các ứng dụng y tế.
Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về quá trình oxy hóa của ion sắt (II). [Fe(OH)2] thành các ion sắt (III) [Fe(OH)3]bao gồm cơ chế phản ứng, điều kiện, các yếu tố ảnh hưởng và ứng dụng thực tế của quá trình này.
Phản ứng của Fe(OH)2 với oxy và nước
Sự hình thành Fe(OH)3 từ Fe(OH)2 thông qua phản ứng oxy hóa
Khi các ion sắt (II) [Fe(OH)2] Khi tiếp xúc với oxy (O2) và nước (H2O) trong môi trường lưỡng tính (pH trung tính hoặc kiềm), phản ứng oxy hóa xảy ra, dẫn đến sự chuyển đổi Fe(OH)2 thành Fe(OH)3. Phản ứng hóa học có thể được biểu diễn như sau:
Fe(OH)2 + O2 + H2O → Fe(OH)3
Trong phản ứng này, các ion sắt(II) [Fe(OH)2] bị oxy hóa thành ion sắt(III) [Fe(OH)3]. Oxy (O2) đóng vai trò là chất oxy hóa và nước (H2O) cung cấp proton để tạo thành Fe(OH)3.
Quá trình này diễn ra ở nhiệt độ và áp suất môi trường xung quanh, thường đi kèm với sự kết tủa Fe(OH)3 dưới dạng kết tủa tinh thể màu nâu đỏ. Sản phẩm cuối cùng của phản ứng là Fe(OH)3, một chất rắn kết tinh, có thể được sử dụng trong nhiều ứng dụng khác nhau.
Vai trò của oxy trong quá trình chuyển đổi Fe(OH)2 thành Fe(OH)3
Oxy (O2) là chất oxy hóa mạnh, đóng vai trò quan trọng trong quá trình chuyển hóa Fe(OH)2 thành Fe(OH)3. Cụ thể, oxy tham gia phản ứng oxy hóa, làm tăng số oxy hóa của sắt từ +2 (Fe2+) lên +3 (Fe3+).
Sự có mặt của oxy là cần thiết để quá trình oxy hóa xảy ra, vì oxy sẽ cung cấp electron để oxy hóa Fe(OH)2 thành Fe(OH)3. Nếu không có oxy, phản ứng sẽ không xảy ra hoặc sẽ diễn ra rất chậm.
Ngoài ra, oxy còn tham gia vào quá trình kết tủa Fe(OH)3 từ các ion Fe3+ trong dung dịch, góp phần tạo nên sản phẩm cuối cùng của phản ứng.
Cơ chế phản ứng của Fe(OH)2 với O2 và H2O
Các bước của phản ứng oxy hóa Fe(OH)2
Quá trình oxy hóa Fe(OH)2 thành Fe(OH)3 bao gồm các bước sau:
- Sự oxy hóa các ion sắt(II) [Fe(OH)2] thành các ion sắt (III) [Fe(OH)3]:
- Fe(OH)2 + O2 → 2 Fe(OH)3
- Kết tủa Fe(OH)3 từ ion Fe3+ trong dung dịch:
- Fe3+ + 3 OH- → Fe(OH)3 (r)
Ở bước đầu tiên, oxy (O2) hoạt động như một chất oxy hóa, nhận electron từ Fe(OH)2 để tạo thành Fe(OH)3. Điều này làm tăng số oxy hóa của sắt từ +2 lên +3.
Ở bước thứ hai, các ion Fe3+ kết hợp với các ion hydroxyl (OH-) trong dung dịch để tạo thành kết tủa Fe(OH)3. Quá trình này xảy ra khi nồng độ các ion Fe3+ và OH- vượt quá giới hạn độ hòa tan.
Điều kiện thuận lợi cho phản ứng
Để phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 diễn ra tốt cần đảm bảo các điều kiện sau:
- Môi trường lưỡng tính (pH trung tính hoặc kiềm):
- Phản ứng xảy ra tốt nhất ở khoảng pH từ 6 đến 14, tức là trong môi trường lưỡng tính hoặc kiềm.
- Trong môi trường có tính axit (pH thấp), quá trình oxy hóa bị ức chế.
- Sự có mặt của oxy (O2):
- Oxy là chất oxy hóa không thể thiếu trong phản ứng chuyển Fe(OH)2 thành Fe(OH)3.
- Nồng độ oxy càng cao thì tốc độ phản ứng càng nhanh.
- Nhiệt độ thích hợp:
- Phản ứng diễn ra tốt nhất ở nhiệt độ phòng (khoảng 20-25°C).
- Ở nhiệt độ thấp hơn, tốc độ phản ứng chậm lại.
- Ở nhiệt độ cao hơn, Fe(OH)3 có thể phân hủy thành các sản phẩm khác.
- Thời gian phản hồi:
- Phản ứng chuyển đổi Fe(OH)2 thành Fe(OH)3 cần một khoảng thời gian nhất định để hoàn thành.
- Thời gian phản ứng thường kéo dài từ vài phút đến vài giờ, tùy thuộc vào các điều kiện khác.
Kiểm soát tốt các yếu tố này sẽ giúp quá trình oxy hóa Fe(OH)2 thành Fe(OH)3 diễn ra hiệu quả.
Tính chất hóa học của Fe(OH)2 và Fe(OH)3
Tính chất của Fe(OH)2
Fe(OH)2 là chất rắn kết tinh màu xanh lam hoặc xanh lục, thường được hình thành khi các ion sắt(II) [Fe2+] kết hợp với các ion hydroxyl (OH-) trong dung dịch.
Sau đây là một số tính chất đặc trưng của Fe(OH)2:
- Dạng tinh thể, không tan trong nước, dễ bị oxy hóa trong không khí.
- Chất lưỡng tính, có thể phản ứng với cả axit và bazơ.
- Là chất khử, nó dễ bị oxy hóa thành ion sắt (III). [Fe(OH)3].
- Ở nhiệt độ cao, Fe(OH)2 có thể phân hủy thành Fe3O4 (có từ tính).
Tính chất của Fe(OH)3
Fe(OH)3 là chất rắn kết tinh màu nâu đỏ, thường được hình thành khi các ion sắt(III) [Fe3+] kết hợp với các ion hydroxyl (OH-) trong dung dịch.
Sau đây là một số tính chất đặc trưng của Fe(OH)3:
- Dạng tinh thể, không tan trong nước, khá bền trong không khí.
- Chất lưỡng tính, có thể phản ứng với cả axit và bazơ.
- Là một chất oxy hóa, nó có thể oxy hóa các chất khử khác.
- Ở nhiệt độ cao, Fe(OH)3 có thể phân hủy thành các oxit sắt như Fe2O3 và Fe3O4.
Sự khác biệt về tính chất hóa học giữa Fe(OH)2 và Fe(OH)3 phản ánh sự khác biệt về số oxi hóa của sắt, từ +2 (Fe2+) đến +3 (Fe3+). Điều này ảnh hưởng đến tính chất và ứng dụng của hai chất này trong các lĩnh vực khác nhau.
Ứng dụng của phản ứng Fe(OH)2 + O2 + H2O → Fe(OH)3
Vai trò trong xử lý nước và nước thải
Phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 có ứng dụng quan trọng trong xử lý nước và nước thải. Cụ thể:
- Loại bỏ sắt (II) trong nước: Fe(OH)2 có thể được oxy hóa thành Fe(OH)3 để loại bỏ các ion sắt (II) khỏi nguồn nước, cải thiện chất lượng nước.
- Xử lý nước thải: Fe(OH)3 kết tủa có thể được sử dụng để loại bỏ kim loại nặng, phốt phát và các chất ô nhiễm khác trong nước thải.
- Nâng cao hiệu quả lắng: Sự hình thành kết tủa Fe(OH)3 giúp các chất lơ lửng trong nước lắng nhanh hơn, tăng hiệu quả lắng và làm trong nước.
Ứng dụng trong sản xuất chất màu và chất xúc tác
Phản ứng oxi hóa Fe(OH)2 thành Fe(OH)3 cũng được áp dụng trong:
- Sản xuất bột màu: Fe(OH)3 là nguyên liệu quan trọng để sản xuất các loại màu như oxit sắt (III) (Fe2O3) và oxit sắt (II,III) (Fe3O4), được sử dụng rộng rãi trong các ngành công nghiệp sơn, mực in, mỹ phẩm, v.v.
- Chuẩn bị chất xúc tác: Fe(OH)3 có thể được sử dụng để chuẩn bị chất xúc tác gốc sắt, được ứng dụng trong nhiều lĩnh vực như lọc khí, xử lý nước, công nghiệp hóa chất, v.v.
Các ứng dụng khác
Ngoài các ứng dụng trên, phản ứng oxi hóa Fe(OH)2 thành Fe(OH)3 còn có thể ứng dụng trong:
- Y tế: Fe(OH)3 được sử dụng như một chất bổ sung sắt trong thuốc và thực phẩm chức năng để điều trị thiếu máu do thiếu sắt.
- Địa chất: Quá trình oxy hóa Fe(OH)2 được quan sát thấy trong môi trường địa chất, ảnh hưởng đến tính chất của đất, trầm tích và quặng sắt.
- Công nghiệp: Fe(OH)3 có thể được sử dụng làm phụ gia trong sản xuất xi măng, gốm sứ, thủy tinh, v.v.
Như vậy, phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 có ý nghĩa rất lớn trong nhiều lĩnh vực, từ xử lý môi trường, công nghiệp đến y học và địa chất.
Điều kiện phản ứng để tạo ra Fe(OH)3 từ Fe(OH)2
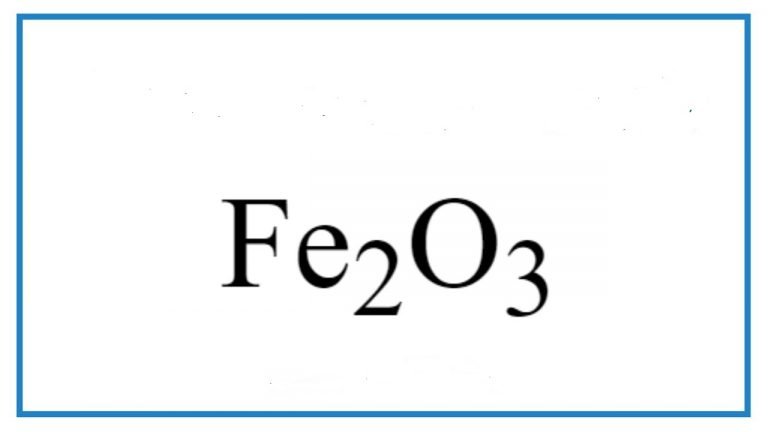
Các yếu tố ảnh hưởng đến tốc độ phản ứng
Tốc độ phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 phụ thuộc vào các yếu tố sau:
- Độ pH của môi trường:
- Phản ứng xảy ra nhanh nhất trong môi trường lưỡng tính hoặc kiềm (pH 6-14).
- Trong môi trường có tính axit (pH thấp), tốc độ phản ứng sẽ chậm lại do sự ức chế proton.
- Nồng độ oxy (O2):
- Nồng độ oxy càng cao thì tốc độ phản ứng càng nhanh vì oxy đóng vai trò là chất oxy hóa.
- Trong môi trường kín hoặc thiếu oxy, phản ứng sẽ diễn ra rất chậm hoặc không xảy ra. – Sự có mặt của oxy là yếu tố quan trọng quyết định sự thành công của quá trình chuyển đổi Fe(OH)2 thành Fe(OH)3.
- Nhiệt độ:
- Phản ứng thường diễn ra nhanh hơn ở nhiệt độ cao do động năng phân tử tăng lên, tạo điều kiện thuận lợi cho phản ứng hóa học.
- Tuy nhiên, nhiệt độ quá cao có thể gây phân hủy hoặc làm mất ổn định sản phẩm Fe(OH)3.
Các yếu tố khác
Ngoài các yếu tố cơ bản như độ pH, nồng độ oxy và nhiệt độ, còn có một số yếu tố khác ảnh hưởng đến tốc độ phản ứng:
- Kích thước hạt: Các hạt lớn thường có diện tích tiếp xúc lớn hơn, giúp phản ứng xảy ra nhanh hơn.
- Ánh sáng: Năng lượng ánh sáng có thể kích thích một số phản ứng phụ hoặc đẩy nhanh phản ứng chính.
- Chất xúc tác: Có thể có một số chất xúc tác có thể tăng tốc hoặc cải thiện hiệu quả của phản ứng oxy hóa này.
Các yếu tố trên sẽ quyết định việc điều chỉnh các điều kiện phản ứng để tạo ra Fe(OH)3 từ Fe(OH)2 một cách hiệu quả và nhanh chóng, ứng dụng trong các lĩnh vực khác nhau theo nhu cầu cụ thể.
Ý nghĩa của phản ứng Fe(OH)2 + O2 + H2O → Fe(OH)3
Phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 có nhiều ý nghĩa quan trọng:
- Xử lý môi trường: Quá trình này được sử dụng rộng rãi trong xử lý nước và nước thải, giúp loại bỏ chất ô nhiễm và cải thiện chất lượng nước.
- Sản xuất công nghiệp: Fe(OH)3 từ phản ứng này được sử dụng để sản xuất chất màu, chất xúc tác và các sản phẩm công nghiệp khác.
- Ứng dụng y tế: Fe(OH)3 có thể được sử dụng trong ngành dược phẩm để sản xuất thuốc bổ sung sắt.
- Vai trò trong nghiên cứu khoa học: Quá trình oxy hóa Fe(OH)2 mở ra nhiều cơ hội nghiên cứu trong lĩnh vực hóa học và môi trường.
Với nhiều ứng dụng và ý nghĩa khác nhau, phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 đóng vai trò quan trọng và không thể phủ nhận trong nhiều lĩnh vực khác nhau.
Kết luận
Trong bối cảnh quá trình oxy hóa Fe(OH)2 thành Fe(OH)3, chúng ta đã tìm hiểu về cơ chế phản ứng, vai trò của oxy, tính chất hóa học của Fe(OH)2 và Fe(OH)3, ứng dụng của phản ứng, các điều kiện cần thiết và các yếu tố ảnh hưởng đến tốc độ phản ứng. Việc hiểu được quá trình này không chỉ giúp chúng ta ứng dụng hiệu quả vào thực tế mà còn mở ra nhiều cơ hội nghiên cứu và ứng dụng mới trong tương lai.
Quá trình chuyển đổi Fe(OH)2 thành Fe(OH)3 cần một khoảng thời gian nhất định để hoàn thành.
- Thời gian phản ứng thường kéo dài từ vài phút đến vài giờ, tùy thuộc vào các điều kiện khác.
Kiểm soát tốt các yếu tố này sẽ giúp quá trình oxy hóa Fe(OH)2 thành Fe(OH)3 diễn ra hiệu quả.
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














