Phản ứng oxi hóa khử là phản ứng hóa học trong đó số oxi hóa của một hoặc nhiều nguyên tử thay đổi. Phản ứng oxi hóa khử thường được phân loại thành hai loại: phản ứng oxi hóa khử hoàn toàn và phản ứng oxi hóa khử không hoàn toàn. Phản ứng oxi hóa khử giữa NaOH và Cl2 là phản ứng oxi hóa khử không hoàn toàn, trong đó Cl2 đóng vai trò vừa là chất oxi hóa vừa là chất khử.
NaOH + Cl2 → NaCl + NaClO + H2O
Phản ứng oxi hóa khử giữa NaOH và Cl2
Phản ứng oxi hóa khử giữa NaOH và Cl2 là phản ứng hóa học xảy ra giữa natri hiđroxit (NaOH) và clo (Cl2), tạo thành natri clorua (NaCl), natri clorat (NaClO) hoặc natri clorat (NaClO3), tùy thuộc vào điều kiện phản ứng.
Điều kiện phản ứng
Phản ứng oxy hóa khử giữa NaOH và Cl2 phụ thuộc vào nhiều yếu tố, bao gồm:
- Nồng độ NaOH và Cl2: Nồng độ NaOH và Cl2 càng cao thì tốc độ phản ứng càng nhanh.
- Nhiệt độ: Nhiệt độ phản ứng càng cao thì tốc độ phản ứng càng nhanh.
- Áp suất: Áp suất phản ứng càng cao thì tốc độ phản ứng càng nhanh.
- Chất xúc tác: Chất xúc tác có thể làm tăng tốc độ phản ứng.
Sản phẩm phản ứng
Sản phẩm của phản ứng oxi hóa khử giữa NaOH và Cl2 phụ thuộc vào điều kiện phản ứng. Nếu phản ứng diễn ra trong điều kiện bình thường, sản phẩm chính là NaClO. Nếu phản ứng diễn ra trong điều kiện nhiệt độ cao, sản phẩm chính là NaClO3.
NaOH + Cl2 → NaCl + NaClO3 + H2O
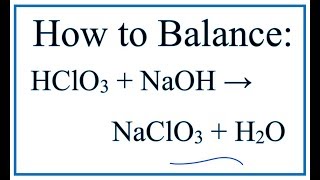
Phản ứng oxi hóa khử giữa NaOH và Cl2
Phản ứng oxi hóa khử giữa NaOH và Cl2 là phản ứng hóa học xảy ra giữa natri hiđroxit (NaOH) và clo (Cl2), tạo thành natri clorua (NaCl), natri clorat (NaClO3) và nước (H2O).
Phân loại phản ứng giữa NaOH và Cl2
Phản ứng giữa NaOH và Cl2 là phản ứng oxi hóa – khử, trong đó:
- Cl2 là chất oxi hóa vì trong phản ứng Cl2 nhận electron.
- NaOH là chất khử vì trong phản ứng NaOH nhường electron.
Số oxi hóa của các nguyên tử trong phản ứng NaOH + Cl2 → NaCl + NaClO3 + H2O
- Số oxi hóa của Cl trong Cl2 là 0.
- Số oxi hóa của Cl trong NaCl là -1.
- Số oxi hóa của Cl trong NaClO3 là +5.
- Số oxi hóa của Na trong NaOH là +1.
- Số oxi hóa của Na trong NaCl là +1.
- Số oxi hóa của O trong NaOH là -2.
- Số oxi hóa của O trong NaCl là -2.
- Số oxi hóa của O trong NaClO3 là -2.
- Số oxi hóa của H trong NaOH là +1.
- Số oxi hóa của H trong H2O là +1.
Định luật bảo toàn electron

Theo định luật bảo toàn electron, tổng số electron bị oxi hóa bằng tổng số electron bị khử. Trong phản ứng NaOH + Cl2 → NaCl + NaClO3 + H2O, Cl2 đã nhận 6 electron và NaOH đã cho 6 electron. Do đó, phản ứng này là phản ứng oxi hóa khử.
Phản ứng oxi hóa khử giữa NaOH và Cl2 theo phương pháp cân bằng electron
Để cân bằng phản ứng oxi hóa khử bằng phương pháp cân bằng electron, chúng ta có thể chia phản ứng thành hai nửa phản ứng:
2Cl- → Cl2 + 2e
2OH- → O2 + H2O + 2e
Cộng hai nửa phản ứng lại, ta được:
2Cl- + 2OH- → Cl2 + O2 + H2O
Thêm NaCl vào cả hai vế của phương trình, ta thu được:
2Cl- + 2OH- + NaCl → Cl2 + O2 + H2O + NaCl
Rút gọn phương trình, ta được:
2NaOH + Cl2 → NaClO + NaCl + H2O
Kết luận
Phản ứng oxi hóa khử giữa NaOH và Cl2 là phản ứng hóa học quan trọng có ứng dụng rộng rãi trong công nghiệp và đời sống. Phản ứng này được sử dụng để tạo ra nhiều hợp chất hóa học quan trọng như NaClO, NaClO3, NaOH và Cl2. Đồng thời, phản ứng oxi hóa khử giữa NaOH và Cl2 cũng là một ví dụ điển hình của định luật bảo toàn electron và phương pháp cân bằng electron trong phản ứng hóa học.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














