Phản ứng hóa học là một lĩnh vực rất quan trọng trong khoa học, và việc nghiên cứu các phản ứng hóa học giữa các chất khác nhau đóng vai trò rất quan trọng trong việc phát triển các công nghệ mới, cũng như trong việc hiểu sâu hơn về các quá trình hóa học xảy ra trong tự nhiên. Trong bài viết này, chúng ta sẽ tìm hiểu về phản ứng hóa học giữa lưu huỳnh (S) và axit sunfuric (H2SO4), bao gồm các sản phẩm của phản ứng, các điều kiện để tiến hành phản ứng, cân bằng phương trình, điều chế khí SO2 trong phòng thí nghiệm, ứng dụng của phản ứng, tính chất hóa học của SO2, tác hại của khí SO2, các biện pháp phòng ngừa khi sử dụng H2SO4 và một số lưu ý khi tiến hành phản ứng.
Sản phẩm của phản ứng giữa S và H2SO4

Phản ứng giữa lưu huỳnh và axit sunfuric
Khi lưu huỳnh (S) phản ứng với axit sunfuric (H2SO4), sản phẩm chính của phản ứng là khí lưu huỳnh đioxit (SO2) và nước (H2O). Phản ứng hóa học có thể được mô tả bằng phương trình hóa học sau:
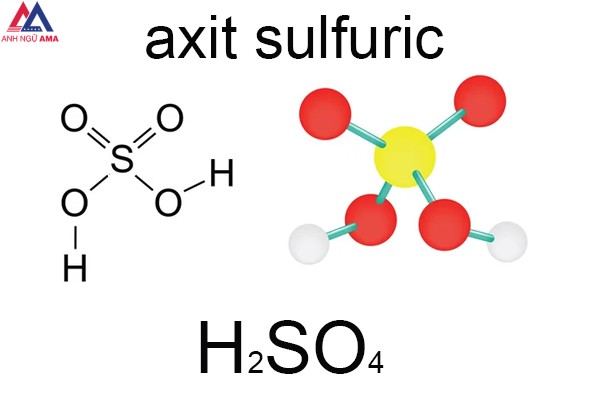
S + 2H2SO4 → SO2 + 2H2O
Trong phản ứng này, lưu huỳnh đóng vai trò là chất khử, trong khi axit sunfuric đóng vai trò là chất oxy hóa. Khi phản ứng diễn ra, lưu huỳnh bị oxy hóa, chuyển từ trạng thái khử (S0) sang trạng thái oxy hóa (S+4) trong sản phẩm khí lưu huỳnh đioxit, trong khi axit sunfuric bị khử, chuyển từ trạng thái oxy hóa (S+6) sang trạng thái khử (S+4) trong sản phẩm khí lưu huỳnh đioxit.
Cấu trúc và tính chất của sản phẩm SO2
Sản phẩm chính của phản ứng giữa lưu huỳnh và axit sunfuric là khí lưu huỳnh đioxit (SO2). Khí SO2 có cấu trúc phân tử tam giác phẳng, với một nguyên tử lưu huỳnh ở trung tâm và hai nguyên tử oxy ở hai bên. Cấu trúc này cho phép phân tử SO2 có một cặp electron không liên kết trên nguyên tử lưu huỳnh, làm cho phân tử SO2 phân cực.
Về tính chất hóa học, SO2 là chất khí không màu, có mùi hăng, dễ tan trong nước tạo thành dung dịch axit sunfuric (H2SO3). Khí SO2 cũng có tính oxi hóa, tính khử và có thể tham gia nhiều phản ứng hóa học khác nhau.
Điều kiện để tiến hành phản ứng S + H2SO4
Nhiệt độ và áp suất
Để phản ứng giữa lưu huỳnh (S) và axit sunfuric (H2SO4) xảy ra, phải đáp ứng một số điều kiện về nhiệt độ và áp suất. Thông thường, phản ứng này diễn ra ở nhiệt độ cao, khoảng 400-500°C. Ở nhiệt độ này, lưu huỳnh và axit sunfuric sẽ phản ứng với nhau, tạo thành sản phẩm là khí lưu huỳnh đioxit (SO2) và nước (H2O).
Về áp suất, phản ứng này thường diễn ra ở áp suất khá cao, khoảng 10-20 atm. Điều này giúp tăng tốc độ phản ứng và tăng hiệu suất thu hồi sản phẩm SO2.
Sự xúc tác
Trong một số trường hợp, để tăng tốc độ phản ứng và hiệu suất thu hồi sản phẩm SO2, người ta có thể sử dụng chất xúc tác. Một trong những chất xúc tác thường được sử dụng là vanadi pentoxit (V2O5). Chất xúc tác này sẽ tham gia vào quá trình oxy hóa khử, giúp tăng tốc độ phản ứng và tăng hiệu suất thu hồi sản phẩm SO2.
Ngoài vanadi pentoxit, phản ứng này cũng có thể sử dụng các chất xúc tác khác như silic dioxit (SiO2), nhôm oxit (Al2O3) hoặc sắt oxit (Fe2O3).
Cân bằng phương trình phản ứng
Để viết phương trình hóa học cân bằng cho phản ứng giữa lưu huỳnh (S) và axit sunfuric (H2SO4), chúng ta có thể áp dụng các nguyên tắc cân bằng phương trình hóa học sau:
- Xác định các chất phản ứng: S và H2SO4.
- Xác định sản phẩm của phản ứng: SO2 và H2O.
- Cân bằng số nguyên tử của mỗi nguyên tố:
- Lưu huỳnh (S): 1 nguyên tử bên trái, 1 nguyên tử bên phải.
- Oxy (O): 4 nguyên tử bên trái, 2 nguyên tử bên phải.
- Hiđro (H): 2 nguyên tử bên trái, 2 nguyên tử bên phải.
- Viết phương trình cân bằng: S + 2H2SO4 → SO2 + 2H2O
Phương trình trên được cân bằng theo số nguyên tử của mỗi nguyên tố tham gia phản ứng.
Điều chế khí SO2 trong phòng thí nghiệm
Phương pháp chế biến
Để điều chế khí SO2 trong phòng thí nghiệm, người ta thường dùng phản ứng giữa lưu huỳnh (S) và axit sunfuric (H2SO4). Quá trình điều chế khí SO2 có thể mô tả như sau:
- Chuẩn bị hóa chất: Lưu huỳnh dạng bột (S) và axit sunfuric nồng độ cao (H2SO4).
- Phản ứng: Cho một lượng nhỏ lưu huỳnh vào bình thủy tinh hoặc gốm, sau đó thêm một lượng axit sunfuric vừa đủ. Đun nóng bình phản ứng đến khoảng 400-500°C.
- Thu hồi sản phẩm: Khí SO2 sinh ra sẽ thoát ra khỏi lò phản ứng và có thể được thu thập bằng cách dẫn vào bể chứa hoặc làm mát để tách khí.
Lưu ý rằng quá trình điều chế khí SO2 trong phòng thí nghiệm phải tuân thủ các quy định về an toàn hóa chất, đặc biệt là khi làm việc với axit sunfuric, một chất ăn mòn và oxy hóa mạnh.
Biện pháp an toàn
Khi điều chế khí SO2 trong phòng thí nghiệm, phải đảm bảo các biện pháp an toàn sau:
- Sử dụng thiết bị bảo vệ cá nhân như kính an toàn, găng tay chống hóa chất và áo choàng bảo hộ.
- Thực hiện phản ứng trong tủ hút hoặc khu vực thông gió tốt.
- Không để axit sunfuric bắn vào mắt, da hoặc quần áo.
- Nếu axit sunfuric bị đổ hoặc bắn vào người, hãy rửa ngay bằng nước sạch và nếu cần, hãy tìm kiếm sự chăm sóc y tế.
- Sau khi hoàn tất thí nghiệm, hãy vệ sinh sạch sẽ dụng cụ và khu vực làm việc.
Việc thực hiện các biện pháp an toàn này sẽ giúp giảm thiểu rủi ro và đảm bảo an toàn cho người thực hiện thí nghiệm.
Ứng dụng của phản ứng S + H2SO4
Sản xuất axit sunfuric
Phản ứng giữa lưu huỳnh (S) và axit sunfuric (H2SO4) có ứng dụng rất quan trọng trong sản xuất axit sunfuric (H2SO4). Axit sunfuric là một trong những hóa chất công nghiệp quan trọng nhất, được sử dụng rộng rãi trong nhiều lĩnh vực như sản xuất phân bón, hóa chất, dược phẩm và công nghiệp chế biến kim loại.
Quá trình sản xuất axit sunfuric thường bao gồm các bước sau:
- Đốt lưu huỳnh để tạo ra khí SO2.
- Oxy hóa khí SO2 thành khí SO3 bằng phương pháp xúc tác.
- Hấp thụ khí SO3 vào nước tạo thành axit sunfuric.
Phản ứng giữa S và H2SO4 đóng vai trò quan trọng trong bước đầu tiên của quá trình sản xuất axit sunfuric.
Sản xuất xi măng
Ngoài ra, phản ứng giữa lưu huỳnh (S) và axit sunfuric (H2SO4) cũng có ứng dụng trong sản xuất xi măng. Trong quá trình sản xuất xi măng, một trong những nguyên liệu chính là thạch cao (CaSO4). Thạch cao được sản xuất bằng cách phản ứng lưu huỳnh (S) và axit sunfuric (H2SO4), tạo thành sản phẩm CaSO4.
Phản ứng diễn ra như sau:
S + 2H2SO4 → 2SO2 + 2H2O CaCO3 + SO2 + H2O → CaSO4 + CO2
Khí SO2 sinh ra từ phản ứng của lưu huỳnh và axit sunfuric sau đó phản ứng với canxi cacbonat (CaCO3) để tạo thành thạch cao (CaSO4), một trong những thành phần quan trọng trong sản xuất xi măng.
Tính chất hóa học của SO2
Tính axit và tính khử
Như đã đề cập, khí lưu huỳnh đioxit (SO2) có tính axit và khử. Khi hòa tan trong nước, SO2 tạo thành dung dịch axit sunfuric (H2SO3), một axit yếu:
SO2 + H2O ⇌ H2SO3
Dung dịch axit sunfuric (H2SO3) có khả năng tham gia phản ứng oxy hóa – khử, trong đó SO2 đóng vai trò là chất khử.
Ví dụ, khi phản ứng với oxy (O2) trong không khí, SO2 bị oxy hóa thành SO3:
2SO2 + O2 → 2SO3
Ngoài ra, SO2 còn có thể tham gia phản ứng khử với các chất oxi hóa mạnh như pemanganat (KMnO4) hoặc đicromat (K2Cr2O7).
Tính chất khử và oxi hóa
Bên cạnh tính axit, SO2 còn thể hiện tính khử và tính oxi hóa, tùy thuộc vào điều kiện phản ứng.
Ở dạng khí, SO2 có thể tham gia phản ứng oxy hóa, với SO2 đóng vai trò là chất khử. Ví dụ, nó phản ứng với oxy (O2) trong không khí để tạo thành SO3.
Tuy nhiên, dưới dạng dung dịch axit sunfuric (H2SO3), SO2 có thể đóng vai trò là chất khử, có thể tham gia phản ứng oxy hóa – khử với các chất oxy hóa mạnh.
Việc hiểu được tính chất hóa học của SO2 rất quan trọng, giúp chúng ta dự đoán và kiểm soát các phản ứng hóa học mà khí này có thể tham gia.
Tính chất vật lý
SO2 là một loại khí không màu có mùi đặc trưng, thay đổi theo nồng độ. Ở nhiệt độ và áp suất bình thường, SO2 tồn tại dưới dạng khí. SO2 có điểm nóng chảy và điểm sôi tương đối thấp (-72,7°C và -10°C), thuận tiện cho việc sản xuất và lưu trữ.
SO2 ở dạng khí có thể hòa tan trong nước tạo thành axit sunfuric (H2SO3), tuy nhiên dung dịch này chỉ tồn tại trong môi trường axit và không ổn định.
Tác hại của khí SO2
Đối với con người
Khí SO2 là một loại khí độc, khi hít phải sẽ gây ra nhiều tác hại đến sức khỏe con người. Một số tác hại của khí SO2 đối với sức khỏe con người bao gồm:
- Gây kích ứng mắt và đường hô hấp: Khí SO2 có thể gây cảm giác nóng rát ở mắt và cũng gây ra các bệnh nhiễm trùng đường hô hấp, đặc biệt đối với những người mắc các vấn đề về hô hấp như hen suyễn.
- Gây ra các vấn đề về hô hấp: Tiếp xúc lâu dài với khí SO2 có thể gây ra bệnh viêm phổi, viêm phế quản, làm cho hệ hô hấp yếu và dễ bị tổn thương.
- Gây kích ứng da và niêm mạc: Khí SO2 có thể gây kích ứng da và niêm mạc, khiến da khô, nứt nẻ hoặc gây ra các vấn đề về da như phát ban và viêm.
Đối với môi trường
Ngoài việc ảnh hưởng đến sức khỏe con người, khí SO2 còn gây ra nhiều vấn đề về môi trường.
- Ô nhiễm không khí: Khí SO2 là một trong những chất gây ô nhiễm không khí nghiêm trọng, góp phần gây ô nhiễm không khí đô thị và công nghiệp.
- Axit hóa môi trường: SO2 kết hợp với nước trong không khí tạo thành axit sunfurơ (H2SO4), gây ra mưa axit. Mưa axit có thể ảnh hưởng đến đa dạng sinh học, đất, tài nguyên nước và cơ sở hạ tầng.
Kiểm soát và giảm thiểu lượng khí SO2 thải ra môi trường là một trong những vấn đề cấp bách hiện nay, góp phần bảo vệ sức khỏe con người và môi trường sống.
Thận trọng khi sử dụng H2SO4
Khi làm việc với axit sunfuric (H2SO4), một tác nhân có tính ăn mòn và oxy hóa cao, phải tuân thủ các biện pháp an toàn sau đây để đảm bảo an toàn cho người lao động và môi trường:
- Sử dụng thiết bị bảo vệ cá nhân: Kính an toàn, găng tay chống axit và áo choàng chống hóa chất là những thiết bị bảo vệ cần thiết khi tiếp xúc với axit sunfuric.
- Làm việc trong môi trường thông gió tốt: Đảm bảo không gian làm việc có đủ không khí trong lành để hạn chế sự ngưng tụ của khí axit.
- Tránh tiếp xúc trực tiếp với axit: Tránh tiếp xúc với da, mắt hoặc quần áo. Trong trường hợp tiếp xúc, rửa ngay bằng nước sạch và tìm tư vấn y tế.
- Bảo quản và xử lý hóa chất đúng cách: Axit sunfuric phải được bảo quản trong thùng chứa chuyên dụng và xử lý theo đúng quy định về an toàn.
- Sử dụng thiết bị bảo vệ: Sử dụng tủ hút khí độc và thùng chứa chất thải hóa học để thu gom và xử lý chất thải axit sunfuric.
Việc tuân thủ các biện pháp phòng ngừa khi sử dụng axit sunfuric là cần thiết để đảm bảo an toàn cho người lao động và môi trường xung quanh.
Lưu ý khi thực hiện phản ứng
Khi thực hiện phản ứng giữa lưu huỳnh (S) và axit sunfuric (H2SO4), cần lưu ý những điều sau:
- Thực hiện các quy định về an toàn: Luôn đeo thiết bị bảo vệ cá nhân, làm việc ở nơi thông gió tốt và tuân thủ các quy định về an toàn hóa chất.
- Kiểm tra hóa học: Trước khi sử dụng, kiểm tra tính chất và chất lượng của lưu huỳnh và axit sunfuric để đảm bảo hiệu suất của phản ứng.
- Thực hiện phản ứng trong điều kiện được kiểm soát: Đảm bảo nhiệt độ và áp suất phản ứng đủ để thực hiện phản ứng một cách hiệu quả và an toàn.
- Thu gom sản phẩm phản ứng: Đảm bảo thu gom và xử lý đúng cách các sản phẩm phản ứng để tránh thải khí SO2 ra môi trường.
- Vệ sinh khu vực làm việc: Sau khi hoàn tất phản ứng, phải vệ sinh sạch sẽ khu vực làm việc và các dụng cụ sử dụng để đảm bảo an toàn và sạch sẽ.
Việc thực hiện các biện pháp phòng ngừa trên sẽ giúp phản ứng giữa lưu huỳnh và axit sunfuric diễn ra suôn sẻ và an toàn.
Kết luận
Trong bài viết này, chúng ta đã tìm hiểu về phản ứng hóa học giữa lưu huỳnh và axit sunfuric, các sản phẩm và điều kiện phản ứng, cũng như các ứng dụng và tính chất của khí SO2. Chúng ta cũng đã tìm hiểu về tác hại của khí SO2 đối với con người và môi trường, cũng như các biện pháp phòng ngừa khi sử dụng axit sunfuric. Hy vọng, kiến thức từ bài viết sẽ giúp ích cho bạn trong công việc và học tập hàng ngày. Luôn tuân thủ các biện pháp an toàn và thực hiện các biện pháp phòng ngừa khi làm việc với hóa chất để đảm bảo an toàn cho bản thân và môi trường. Chúc bạn thành công!
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














