Phản ứng este hóa là một quá trình hóa học quan trọng trong tổng hợp hữu cơ, trong đó este được hình thành từ axit cacboxylic và ancol. Trên thực tế, phản ứng este hóa etyl este CH3COOH + C2H5OH → CH3COOC2H5 + H2O là một ví dụ điển hình của loại phản ứng này. Trong bài viết này, chúng ta sẽ tìm hiểu về các điều kiện, cơ chế, chất xúc tác, ứng dụng và lưu ý khi thực hiện phản ứng este hóa. Ngoài ra, chúng ta cũng sẽ tìm hiểu các phương pháp cân bằng phương trình hóa học, đặc biệt là cân bằng phương trình phản ứng este hóa CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Điều kiện phản ứng este hóa
Nhiệt độ
Nhiệt độ là yếu tố quan trọng trong tốc độ phản ứng este hóa. Nhìn chung, việc tăng nhiệt độ sẽ làm tăng tốc độ phản ứng vì năng lượng cần thiết để vượt qua năng lượng hoạt hóa giảm, do đó làm tăng khả năng va chạm giữa các phân tử. Tuy nhiên, việc tăng nhiệt độ quá nhiều có thể dẫn đến sự phân hủy các sản phẩm hoặc chất xúc tác.
Áp lực
Áp suất cũng ảnh hưởng đến phản ứng este hóa, đặc biệt là khi có khí tham gia vào phản ứng. Tăng áp suất làm tăng số lần va chạm giữa các phân tử, do đó làm tăng khả năng xảy ra phản ứng.
Chất xúc tác
Chất xúc tác đóng vai trò quan trọng trong việc tăng tốc độ phản ứng este hóa bằng cách hạ thấp năng lượng hoạt hóa của phản ứng. Ví dụ, trong phản ứng este hóa etyl este, H2SO4 thường được sử dụng làm chất xúc tác để tăng tốc phản ứng.
Cơ chế phản ứng este hóa
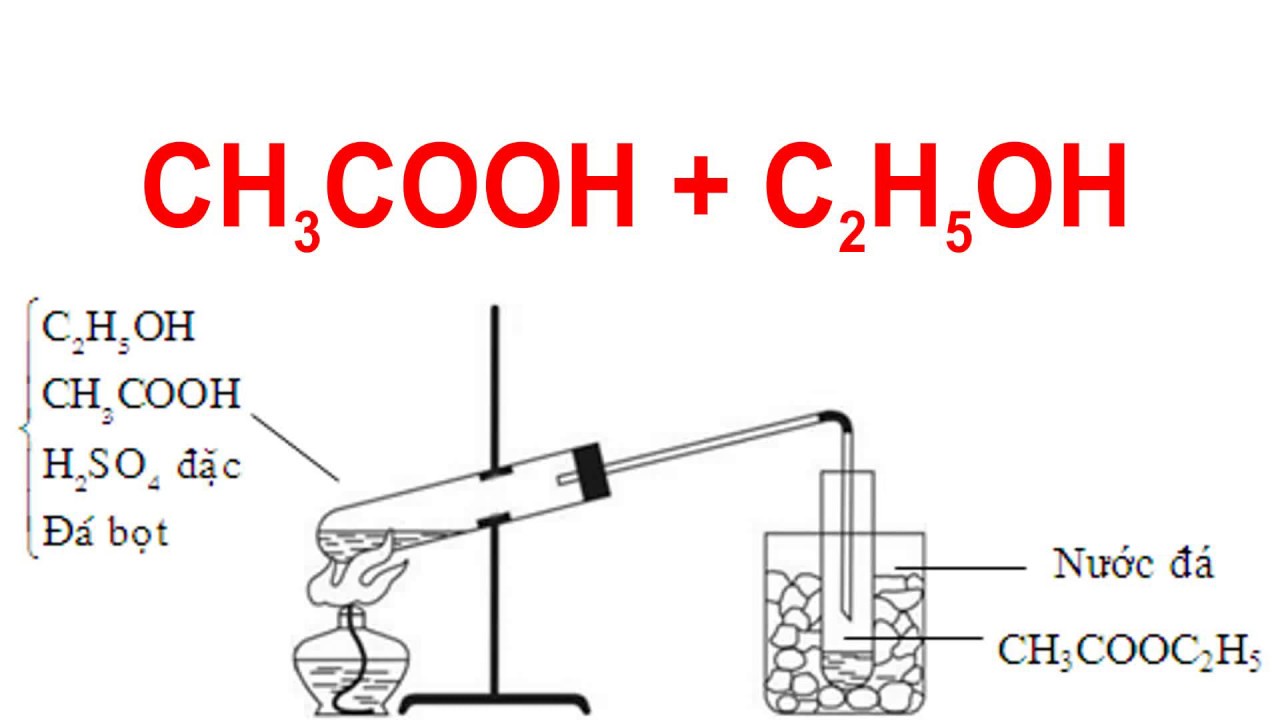
Cơ chế phản ứng este hóa thường diễn ra bằng trao đổi cation, trong đó một proton được chuyển từ axit cacboxylic sang ancol để tạo ra este và nước. Quá trình này thường được mô tả theo các bước sau:
- Proton của axit cacboxylic (ví dụ CH3COOH) được chuyển sang ancol (ví dụ C2H5OH) để tạo thành cation.
- Cation này kết hợp với anion của axit cacboxylic để tạo thành sản phẩm este (ví dụ: CH3COOC2H5) và nước.
Cơ chế này giúp giảm năng lượng hoạt hóa của phản ứng và tạo ra sản phẩm một cách hiệu quả.
Chất xúc tác phản ứng este hóa
Chất xúc tác đóng vai trò quan trọng trong việc tăng tốc độ phản ứng este hóa bằng cách hạ thấp năng lượng hoạt hóa của phản ứng. Một số chất xúc tác thường dùng trong phản ứng este hóa bao gồm H2SO4, HCl, AlCl3, NaOH, v.v. Chúng thường tác động lên các phản ứng trung gian để tạo ra sản phẩm cuối cùng một cách hiệu quả.
Ứng dụng của phản ứng este hóa
Phản ứng este hóa có nhiều ứng dụng thực tế, đặc biệt là trong ngành công nghiệp hóa chất và dược phẩm. Este được sản xuất hàng loạt để sử dụng trong sản xuất nhiều loại sản phẩm từ mỹ phẩm và thuốc đến nước hoa và chất bôi trơn. Ngoài ra, phản ứng este hóa cũng được sử dụng trong tổng hợp hữu cơ để sản xuất các hợp chất phức tạp và quan trọng.
Lưu ý khi thực hiện phản ứng este hóa
Khi thực hiện phản ứng este hóa, cần lưu ý những điểm sau:
- Đảm bảo sử dụng dung dịch axit và cồn có độ tinh khiết cao để tránh ảnh hưởng của tạp chất đến phản ứng.
- Kiểm soát nhiệt độ và áp suất phản ứng để đảm bảo năng suất và chất lượng sản phẩm.
- Sử dụng chất xúc tác với liều lượng và cách dùng phù hợp để tăng tốc độ phản ứng mà không ảnh hưởng đến chất lượng sản phẩm.
Phương pháp cân bằng phương trình phản ứng hóa học
Trong hóa học, cân bằng phương trình phản ứng là một bước quan trọng trong việc xác định tỷ lệ mol giữa chất phản ứng và sản phẩm. Có nhiều phương pháp để cân bằng phương trình phản ứng hóa học, trong đó phương pháp cân bằng electron và phương pháp oxy hóa khử là hai phương pháp phổ biến nhất.
Cân bằng phương trình phản ứng hóa học bằng phương pháp cân bằng electron
Phương pháp cân bằng electron dựa trên việc cân bằng số electron mất đi và số electron thu vào trong quá trình phản ứng. Bằng cách xác định số oxi hóa và số khử của các nguyên tử trong các phân tử tham gia phản ứng, chúng ta có thể xác định số electron tham gia phản ứng và từ đó cân bằng phương trình.
Ví dụ: Cân bằng phương trình phản ứng este hóa CH3COOH + C2H5OH → CH3COOC2H5 + H2O bằng phương pháp cân bằng electron
| Phản ứng ban đầu | Số oxi hóa | Số lượng electron |
|---|---|---|
| CH3COOH | +3 | 0 |
| C2H5OH | 0 | 0 |
| CH3COOC2H5 | +3 | 0 |
| Nước | -2 | 0 |
Từ bảng trên, chúng ta có thể xác định số electron tham gia phản ứng và cân bằng phương trình một cách chính xác.
Cân bằng phương trình phản ứng hóa học bằng phương pháp oxi hóa khử
Phương pháp oxi hóa khử dựa trên việc xác định chất oxi hóa và chất khử trong phản ứng để cân bằng phương trình. Bằng cách xác định số oxi hóa của các nguyên tử trong các phân tử tham gia phản ứng, ta có thể xác định được các quá trình oxi hóa và khử diễn ra trong phản ứng.
Cân bằng phương trình phản ứng este hóa CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Để cân bằng phương trình phản ứng este hóa CH3COOH + C2H5OH → CH3COOC2H5 + H2O, ta cần xác định tỷ lệ mol giữa các chất phản ứng và sản phẩm. Sau đó, ta sẽ cân bằng phương trình bằng cách điều chỉnh các hệ số trước các chất để đảm bảo tỷ lệ mol giữa chúng.
Bước 1: Xác định tỷ lệ mol ban đầu
- CH3COOH: 1 mol
- C2H5OH: 1 mol
- CH3COOC2H5: 0 mol
- H2O: 0 mol
Bước 2: Xác định tỉ lệ mol sau phản ứng
- CH3COOH: 1 – x mol
- C2H5OH: 1 – x mol
- CH3COOC2H5: x mol
- H2O: x mol
Bước 3: Cân bằng phương trình CH3COOH + C2H5OH → CH3COOC2H5 + H2O 1 – x mol 1 – x mol x mol x mol
Khi cân bằng một phương trình, chúng ta có thể xác định giá trị x và từ đó tính được tỷ lệ mol giữa chất phản ứng và sản phẩm.
Kết luận
Trong bài viết này, chúng ta đã tìm hiểu về phản ứng este hóa, bao gồm các điều kiện, cơ chế, chất xúc tác, ứng dụng và lưu ý khi thực hiện phản ứng. Chúng ta cũng đã tìm hiểu các phương pháp cân bằng phương trình hóa học, đặc biệt là cân bằng phương trình phản ứng este hóa CH3COOH + C2H5OH → CH3COOC2H5 + H2O thông qua phương pháp cân bằng electron và phương pháp oxy hóa khử. Hy vọng bài viết sẽ giúp bạn hiểu rõ hơn về phản ứng este hóa và cách cân bằng phương trình phản ứng hóa học đúng.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!
- Quy định xử lý trường hợp tử vong tại cơ sở KCB từ 01/01/2024
- Đổi CMND, CCCD sang căn cước có cần đổi giấy tờ liên quan không?
- Công An Quận Cầu Giấy: Chức Năng, Nhiệm Vụ, Địa Chỉ Và Số Điện Thoại
- Biển số xe 67 là của tỉnh nào?
- Câu Cầu Khiến Là Gì? Khám Phá Đặc Điểm, Công Dụng và Ví Dụ Trong Ngữ Văn Lớp 8














