Phản ứng này là phản ứng tỏa nhiệt mạnh, giải phóng một lượng nhiệt lớn. Nhiệt giải phóng được sử dụng rộng rãi trong cuộc sống hàng ngày, chẳng hạn như làm nhiên liệu cho bếp gas, lò sưởi hoặc động cơ đốt trong.
Etanol, còn được gọi là rượu etylic, là một hợp chất hữu cơ có công thức hóa học là C2H5OH. Khi etanol được đốt cháy trong không khí hoặc oxy nguyên chất, phản ứng hóa học sau đây xảy ra:
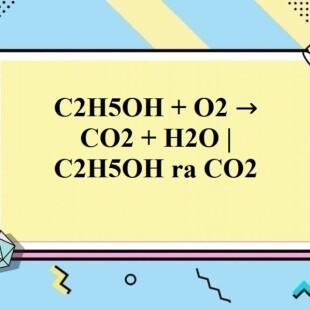
C2H5OH + 3O2 → 2CO2 + 3H2O + nhiệt
Loại phản ứng đốt cháy etanol (C2H5OH → CO2 + H2O)
Phản ứng đốt cháy etanol là phản ứng oxy hóa khử, trong đó etanol đóng vai trò là chất khử và oxy đóng vai trò là chất oxy hóa. Phản ứng diễn ra theo cơ chế bậc nhất, với tốc độ phản ứng phụ thuộc vào nồng độ của cả etanol và oxy.
Ví dụ:
- Khi nến cháy, etanol (trong sáp nến) phản ứng với oxy trong không khí, tạo ra carbon dioxide (CO2) và hơi nước (H2O), đồng thời giải phóng nhiệt làm nóng không khí xung quanh.
Nhiệt cháy của Etanol (C2H5OH → CO2 + H2O + nhiệt)
Lượng nhiệt tỏa ra trong phản ứng đốt cháy etanol được gọi là nhiệt phản ứng. Nhiệt phản ứng của etanol được xác định bằng nhiệt lượng kế và có giá trị là -1366,8 kJ/mol. Dấu âm chỉ ra rằng đây là phản ứng tỏa nhiệt.
Giá trị nhiệt đốt cháy Ethanol
| Giá trị | Ý nghĩa |
| — | — |
| -1366,8 kJ/mol | Lượng nhiệt tỏa ra khi đốt cháy 1 mol etanol ở điều kiện tiêu chuẩn |
Nhiệt cháy của etanol biểu thị lượng nhiệt tỏa ra khi đốt cháy một mol etanol trong điều kiện tiêu chuẩn. Giá trị này quan trọng trong việc tính toán hiệu suất của quá trình đốt cháy etanol, cũng như trong thiết kế các thiết bị sử dụng năng lượng từ etanol.
Biến thiên nhiệt của phản ứng đốt cháy etanol (C2H5OH → CO2 + H2O)
Độ biến thiên nhiệt phản ứng là độ biến thiên nhiệt của hệ khi phản ứng xảy ra. Đối với phản ứng đốt cháy etanol, độ biến thiên nhiệt phản ứng có giá trị bằng nhiệt phản ứng, tức là -1366,8 kJ/mol. Điều này có nghĩa là khi đốt cháy 1 mol etanol, hệ giải phóng 1366,8 kJ nhiệt vào môi trường xung quanh.
Cân bằng nhiệt của phản ứng đốt cháy etanol (C2H5OH → CO2 + H2O + nhiệt)
Cân bằng nhiệt của phản ứng đốt cháy etanol có thể được biểu diễn bằng phương trình sau:
Nhiệt của etanol + Nhiệt của oxy = Nhiệt của cacbon dioxit + Nhiệt của hơi nước
Phương trình này cho thấy tổng nhiệt lượng của các chất phản ứng (etanol và oxy) bằng tổng nhiệt lượng của các sản phẩm phản ứng (cacbon đioxit và hơi nước).
Cân bằng phương trình hóa học của phản ứng đốt cháy etanol (C2H5OH + O2 → CO2 + H2O)
Phương trình hóa học của phản ứng đốt cháy etanol có thể được cân bằng theo các bước sau:
- Xác định số nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình:
- Carbon: 2 bên trái, 1 bên phải
- Hydro: 6 bên trái, 2 bên phải
- Oxy: 1 bên trái, 4 bên phải
- Cân bằng số nguyên tử của mỗi nguyên tố bằng cách thêm hệ số vào trước các chất:
- Nhân 2 vào CO2: 2CO2
- Nhân 3 vào H2O: 3H2O
- Kiểm tra số nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình:
- Carbon: 2 bên trái, 2 bên phải
- Hydro: 6 bên trái, 6 bên phải
- Oxy: 1 + 6 = 7 ở bên trái, 8 ở bên phải
- Cân bằng số nguyên tử oxy bằng cách thêm hệ số đứng trước O2:
- Kiểm tra số nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình:
- Carbon: 2 bên trái, 2 bên phải
- Hydro: 6 bên trái, 6 bên phải
- Oxy: 1 + 6 = 7 ở bên trái, 8 ở bên phải
Phương trình hóa học cân bằng như sau:
C2H5OH + 3O2 → 2CO2 + 3H2O
Kết luận
Phản ứng đốt cháy etanol là một phản ứng hóa học quan trọng có nhiều ứng dụng trong đời sống thực tế. Hiểu được phản ứng này, bao gồm loại phản ứng, nhiệt phản ứng, cân bằng nhiệt và cân bằng phương trình hóa học, có ý nghĩa to lớn trong việc sử dụng etanol hiệu quả và an toàn.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!
- Cách làm sạch ngao nhanh đơn giản – Tất cả những mẹo hiệu quả nhất
- Đến năm 2050, Hà Nam trở thành thành phố trực thuộc Trung ương
- Mâm cúng giao thừa đầy đủ nhất cúng Gia Tiên, Thần Phật
- Mẫu Giấy Nợ Viết Tay: Hướng dẫn chi tiết và các lưu ý quan trọng
- STT Tết Hay Ý Nghĩa Nhất, Cap Tết hay bằng tiếng Việt – Anh – Trung














