Đây là một chủ đề quan trọng và phổ biến trong lĩnh vực hóa học. Phản ứng này xảy ra khi cacbon dioxit (CO2) phản ứng với canxi hiđroxit (Ca(OH)2) để tạo ra canxi cacbonat (CaCO3) và nước (H2O). Để hiểu rõ hơn về quá trình này, chúng ta hãy cùng tìm hiểu những điều cơ bản và ứng dụng thực tế.
1. Phản ứng cân bằng hóa học là gì?

Phản ứng cân bằng hóa học là quá trình xảy ra khi tốc độ phản ứng thuận và tốc độ phản ứng nghịch bằng nhau, dẫn đến nồng độ các chất phản ứng không đổi theo thời gian. Đây là trạng thái động, nghĩa là các chất tiếp tục phản ứng với nhau, nhưng không có sự thay đổi về nồng độ.
3.1. Khái niệm phản ứng cân bằng
Phản ứng cân bằng xảy ra khi tốc độ của phản ứng thuận và tốc độ của phản ứng nghịch bằng nhau. Điều này có nghĩa là:
- Tốc độ hình thành sản phẩm bằng tốc độ phản ứng ngược.
- Nồng độ của chất phản ứng không thay đổi theo thời gian.
- Cân bằng là trạng thái động, không phải trạng thái tĩnh.
3.2. Các yếu tố ảnh hưởng đến phản ứng cân bằng
Có nhiều yếu tố ảnh hưởng đến trạng thái cân bằng của phản ứng hóa học, bao gồm:
- Nhiệt độ: Tăng nhiệt độ sẽ làm tăng tốc độ phản ứng, chuyển dịch cân bằng theo hướng có nhiều sản phẩm hơn.
- Áp suất: Áp suất tăng sẽ làm cân bằng chuyển dịch theo hướng có ít phân tử khí hơn.
- Nồng độ các chất: Tăng nồng độ của một chất tham gia phản ứng sẽ làm dịch chuyển cân bằng theo hướng tạo ra nhiều sản phẩm hơn.
- Sự có mặt của chất xúc tác: Chất xúc tác có thể làm tăng tốc độ phản ứng nhưng không làm thay đổi cân bằng.
3.3. Nguyên lý Le Chatelier
Nguyên lý của Le Chatelier phát biểu rằng: “Khi một hệ thống cân bằng bị tác động bởi một yếu tố bên ngoài, hệ thống sẽ tự điều chỉnh để giảm tác động đó và trở lại trạng thái cân bằng mới”.
Ví dụ, nếu chúng ta tăng nồng độ chất phản ứng, hệ thống sẽ dịch chuyển cân bằng theo hướng tạo ra nhiều sản phẩm hơn để giảm nồng độ chất phản ứng đó.
2. Khái niệm về phản ứng cân bằng CaCO3 + H2O
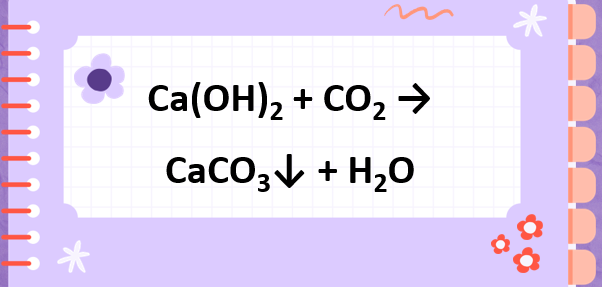
Phản ứng cân bằng CO2 + Ca(OH)2 → CaCO3 + H2O là một ví dụ điển hình về phản ứng hóa học cân bằng. Để hiểu rõ hơn về phản ứng này, chúng ta sẽ tìm hiểu các khái niệm cơ bản.
2.1. Định nghĩa phản ứng
Phản ứng CO2 + Ca(OH)2 → CaCO3 + H2O là phản ứng giữa cacbon dioxit (CO2) và canxi hiđroxit (Ca(OH)2) tạo ra canxi cacbonat (CaCO3) và nước (H2O).
2.2. Cơ chế phản ứng
Phản ứng xảy ra theo các bước sau:
- CO2 hòa tan trong nước tạo thành axit cacbonic (H2CO3): CO2 + H2O ⇌ H2CO3
- H2CO3 phản ứng với Ca(OH)2 tạo thành CaCO3 và H2O: H2CO3 + Ca(OH)2 → CaCO3 + 2H2O
Phản ứng tổng hợp: CO2 + Ca(OH)2 → CaCO3 + H2O
2.3. Tính chất của các chất tham gia
- CO2: Khí không màu, không mùi, không độc. Hòa tan trong nước tạo thành axit cacbonic.
- Ca(OH)2: Chất rắn, màu trắng, không vị, không mùi. Là một bazơ mạnh.
- CaCO3: Chất rắn, màu trắng, không vị, không mùi. Một loại muối.
- H2O: Chất lỏng, không màu, không vị, không mùi.
2.4. Ứng dụng của phản ứng
Phản ứng CO2 + Ca(OH)2 → CaCO3 + H2O có nhiều ứng dụng quan trọng như:
- Trong xử lý nước: Sử dụng Ca(OH)2 để trung hòa axit và loại bỏ cặn bẩn.
- Trong sản xuất xi măng: CaCO3 là nguyên liệu chính để sản xuất xi măng.
- Trong sản xuất thức ăn chăn nuôi: CaCO3 được sử dụng làm chất bổ sung canxi.
- Trong đời sống hàng ngày: CaCO3 được sử dụng trong các sản phẩm như kem đánh răng, chất tẩy rửa,…
3. Nguyên tắc cân bằng phản ứng hóa học
Để hiểu rõ hơn về phản ứng cân bằng CO2 + Ca(OH)2 → CaCO3 + H2O, chúng ta cần nắm vững các nguyên tắc cơ bản để cân bằng phản ứng hóa học.
3.1. Khái niệm cân bằng hóa học
Cân bằng hóa học là trạng thái trong đó phản ứng thuận và nghịch xảy ra với tốc độ bằng nhau, dẫn đến không có sự thay đổi nào về nồng độ các chất phản ứng.
3.2. Hằng số cân bằng
Hằng số cân bằng (K) là tỷ số giữa nồng độ sản phẩm và nồng độ chất phản ứng ở trạng thái cân bằng. Hằng số cân bằng phản ánh mức độ hoàn thành của phản ứng.
3.3. Nguyên lý Le Chatelier
Nguyên lý của Le Chatelier phát biểu rằng: “Khi một hệ thống cân bằng bị tác động bởi một yếu tố bên ngoài, hệ thống sẽ tự điều chỉnh để giảm tác động đó và trở lại trạng thái cân bằng mới”.
Ví dụ, việc tăng nồng độ CO2 sẽ chuyển dịch cân bằng theo hướng tạo ra nhiều CaCO3 hơn.
3.4. Các yếu tố ảnh hưởng đến sự cân bằng
Các yếu tố chính ảnh hưởng đến trạng thái cân bằng của phản ứng hóa học bao gồm:
- Nhiệt độ
- Áp lực
- Nồng độ của các chất tham gia
- Sự hiện diện của chất xúc tác
Hiểu được các nguyên lý cân bằng hóa học sẽ giúp chúng ta nắm bắt được quá trình phản ứng CO2 + Ca(OH)2 → CaCO3 + H2O.
4. Các bước cân bằng phản ứng
Để cân bằng một phản ứng hóa học, chúng ta cần thực hiện theo các bước sau:
4.1. Viết phương trình phản ứng cân bằng
Đầu tiên, chúng ta cần viết một phương trình phản ứng cân bằng, bao gồm các chất phản ứng và sản phẩm. Ví dụ: CO2 + Ca(OH)2 ⇌ CaCO3 + H2O
4.2. Xác định hệ số cân bằng
Tiếp theo, chúng ta cần xác định hằng số cân bằng của phương trình. Hằng số cân bằng được xác định dựa trên định luật bảo toàn nguyên tử và định luật Hess.
4.3. Viết biểu thức hằng số cân bằng
Hằng số cân bằng (K) là tỷ lệ giữa nồng độ sản phẩm và nồng độ chất phản ứng ở trạng thái cân bằng. Ví dụ, đối với phản ứng trên: K = [CaCO3][H2O] / [CO2][Ca(OH)2]
4.4. Tính giá trị của hằng số cân bằng
Giá trị hằng số cân bằng K được tính toán dựa trên dữ liệu thực nghiệm hoặc dữ liệu tham chiếu. Giá trị K phản ánh mức độ hoàn thành của phản ứng.
4.5. Áp dụng nguyên lý Le Chatelier
Khi hệ cân bằng bị ảnh hưởng bởi các yếu tố như nhiệt độ, áp suất hoặc nồng độ, hệ sẽ tự điều chỉnh để giảm tác động đó và trở lại trạng thái cân bằng mới.
Việc nắm vững các bước cân bằng phản ứng sẽ giúp chúng ta hiểu rõ hơn về quá trình phản ứng CO2 + Ca(OH)2 → CaCO3 + H2O.
5. Phương pháp cân bằng phản ứng oxi hóa khử
Ngoài các bước cơ bản để cân bằng phản ứng, chúng ta cũng cần hiểu cách cân bằng phản ứng oxi hóa – khử, đặc biệt khi phản ứng có sự thay đổi số oxi hóa của các nguyên tử.
5.1. Khái niệm phản ứng oxi hóa khử
Phản ứng oxy hóa khử là quá trình trong đó các electron được chuyển giữa các chất phản ứng. Trong phản ứng này, một chất mất electron (oxy hóa) và một chất khác nhận electron (khử).
5.2. Xác định số oxi hóa
Số oxi hóa là số electron mà một nguyên tử mất đi hoặc nhận được khi tham gia phản ứng. Xác định số oxi hóa sẽ giúp chúng ta cân bằng các phương trình phản ứng oxi hóa-khử.
5.3. Cân bằng phương trình oxi hóa khử
Để cân bằng phương trình oxi hóa – khử, chúng ta cần:
- Xác định chất bị oxi hóa và chất bị khử.
- Cân bằng số electron trao đổi.
- Cân bằng các nguyên tố khác (H+, OH-, H2O, e-).
Áp dụng phản ứng CO2 + Ca(OH)2 → CaCO3 + H2O, ta thấy số oxi hóa của các nguyên tử không thay đổi nên đây không phải là phản ứng oxi hóa – khử.
6. Vai trò của chất xúc tác
Chất xúc tác đóng vai trò quan trọng trong nhiều phản ứng hóa học, bao gồm phản ứng CO2 + Ca(OH)2 → CaCO3 + H2O.
6.1. Định nghĩa chất xúc tác
Chất xúc tác là chất tham gia vào phản ứng nhưng không bị tiêu thụ và không xuất hiện trong sản phẩm cuối cùng. Chất xúc tác làm tăng tốc độ phản ứng.
6.2. Cơ chế hoạt động của chất xúc tác
Chất xúc tác làm tăng tốc phản ứng bằng cách cung cấp một con đường năng lượng hoặc làm giảm năng lượng hoạt hóa của phản ứng. Điều này làm cho phản ứng nhanh hơn và hiệu quả hơn.
6.3. Ví dụ về vai trò của chất xúc tác
Trong phản ứng CO2 + Ca(OH)2 → CaCO3 + H2O, chất xúc tác có thể là các ion kim loại như Fe2+ hoặc Mn2+. Chúng có thể làm tăng tốc độ phản ứng bằng cách tạo điều kiện cho các tương tác giữa các phân tử trong phản ứng.
Hiểu được vai trò của chất xúc tác sẽ giúp chúng ta tối ưu hóa quá trình phản ứng và đạt hiệu suất cao nhất.
7. Bài toán cân bằng phản ứng
Để giải các bài toán cân bằng phản ứng hóa học, chúng ta cần áp dụng kiến thức về nguyên lý cân bằng, các bước cân bằng phản ứng và các yếu tố ảnh hưởng đến quá trình phản ứng.
7.1. Ví dụ về bài toán cân bằng phản ứng
Giả sử ta có phản ứng: N2 + 3H2 ⇌ 2NH3. Cần cân bằng phản ứng và tính giá trị hằng số cân bằng K khi biết nồng độ NH3 = 0,5 M, nồng độ N2 = 0,1 M, nồng độ H2 = 0,3 M.
7.2. Giải bài toán cân bằng phản ứng
Để giải quyết vấn đề trên, chúng ta cần:
- Viết phương trình phản ứng cân bằng.
- Xác định hệ số cân bằng.
- Viết biểu thức hằng số cân bằng.
- Tính giá trị hằng số cân bằng K.
- Kiểm tra xem phản ứng có cân bằng không.
Bằng cách giải các bài toán cân bằng phản ứng, chúng ta có thể hiểu rõ hơn về quá trình cân bằng và áp dụng kiến thức vào thực tế.
8. Áp dụng phản ứng cân bằng CaCO3 + H2O
Phản ứng cân bằng CaCO3 + H2O không chỉ là ví dụ minh họa cho nguyên lý cân bằng hóa học mà còn có nhiều ứng dụng trong đời sống hằng ngày và trong công nghiệp.
8.1. Ứng dụng trong sản xuất vật liệu xây dựng
Phản ứng CaCO3 + H2O tạo ra Ca(OH)2, một chất được sử dụng rộng rãi trong sản xuất xi măng và vật liệu xây dựng. Quá trình này đóng vai trò quan trọng trong xây dựng cơ sở hạ tầng và các công trình kiến trúc.
8.2. Ứng dụng trong nông nghiệp
CaCO3 cũng được sử dụng để cải tạo đất trong nông nghiệp. Việc bổ sung CaCO3 vào đất giúp cân bằng độ pH, cung cấp canxi cho cây trồng, từ đó tăng cường sinh trưởng và năng suất.
8.3. Ứng dụng trong ngành thực phẩm
CaCO3 được sử dụng như một chất chống đông trong thực phẩm và thực phẩm chế biến. Nó cũng được sử dụng trong quá trình lọc nước và điều chỉnh độ pH của nước.
Với nhiều ứng dụng đa dạng, phản ứng cân bằng CaCO3 + H2O đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau của đời sống và công nghiệp.
9. Lưu ý khi cân bằng phản ứng hóa học
Khi cân bằng phản ứng hóa học, chúng ta cần lưu ý những điều sau:
- Xác định chính xác chất phản ứng và sản phẩm của phản ứng.
- Xác định hằng số cân bằng dựa trên định luật bảo toàn nguyên tử.
- Tính giá trị hằng số cân bằng K để đánh giá sự hoàn thành của phản ứng.
- Áp dụng nguyên lý Le Chatelier để dự đoán những thay đổi khi các yếu tố tác động đến hệ thống.
Việc tuân thủ các nguyên tắc và lưu ý trên sẽ giúp chúng ta cân bằng phản ứng hóa học một cách chính xác và hiệu quả.
Tài liệu tham khảo
- Atkins, P., & de Paula, J. (2006). Hóa học vật lý của Atkins. Nhà xuất bản Đại học Oxford.
- Chang, R. (2010). Hóa học. McGraw-Hill Education.
- Kotz, JC, Treichel, P., & Townsend, J. (2009). Hóa học và phản ứng hóa học. Cengage Learning.
Kết luận
Trên đây là một số kiến thức cơ bản về phản ứng cân bằng hóa học, qua đó chúng ta hiểu được khái niệm, nguyên lý, các bước cân bằng và ứng dụng của phản ứng CaCO3 + H2O. Việc vận dụng những kiến thức này vào thực tế sẽ giúp chúng ta hiểu rõ hơn về quá trình phản ứng hóa học và tối ưu hóa hiệu suất của chúng. Hy vọng bài viết này sẽ giúp các bạn có cái nhìn tổng quan và chi tiết về chủ đề này.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!
- Cách phối màu đẹp và nghệ thuật không phải ai cũng biết
- Tài khoản Mytv Net miễn phí 2023, Acc Mytv Vip Free
- Nhóm Telegram Gay Việt Nam, gay Trung Quốc miễn phí link 2024
- Nhận thẻ cào miễn phí có seri (Viettel, Vinaphone, Mobiphone, game) chưa nạp
- Podcast Là Gì? Bật Mí Lợi Ích Và Những Kênh “Gây Nghiện” Cho Bạn














