Phương trình hóa học là một công cụ quan trọng giúp chúng ta mô tả, hiểu và dự đoán các quá trình hóa học xảy ra trong cuộc sống hàng ngày cũng như trong các ứng dụng công nghiệp. Trong số các phương trình hóa học, phương trình Al(OH)3 + HCl → AlCl3 + H2O là một ví dụ điển hình để minh họa cho quá trình cân bằng phương trình.
Cân bằng phương trình hóa học cho phản ứng Al(OH)3 + HCl → AlCl3 + H2O không chỉ là một bài tập đơn giản mà còn có ý nghĩa quan trọng trong việc hiểu các quá trình hóa học và ứng dụng của chúng trong thực tế. Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về cách cân bằng phương trình này, vai trò, các bước, lưu ý, ví dụ cụ thể và ý nghĩa ứng dụng của nó trong nhiều lĩnh vực khác nhau.
Phương trình hóa học cân bằng cho phản ứng Al(OH)3 + HCl → AlCl3 + H2O
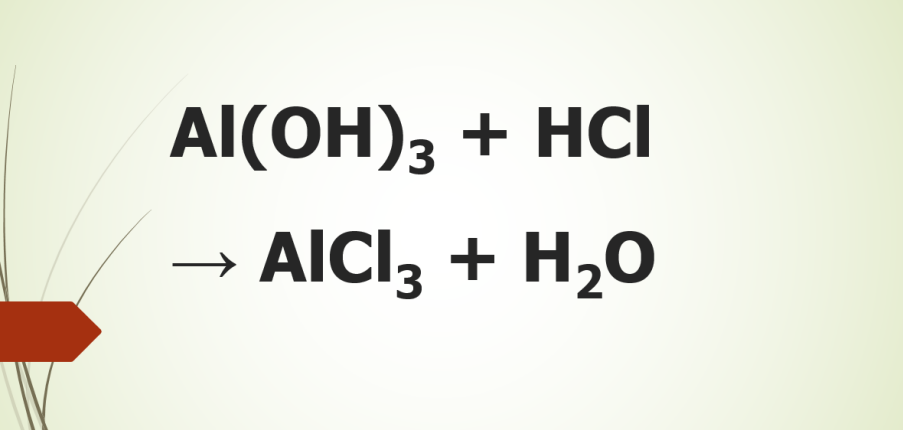
Phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O mô tả phản ứng giữa nhôm hiđroxit (Al(OH)3) và axit clohydric (HCl) để tạo thành nhôm clorua (AlCl3) và nước (H2O).
Các thành phần tham gia phản ứng
- Al(OH)3 (Nhôm Hydroxit): Đây là chất rắn màu trắng, không màu có công thức hóa học là Al(OH)3. Nhôm hydroxit là một bazơ, được sử dụng rộng rãi trong nhiều lĩnh vực như xử lý nước, sản xuất giấy, công nghiệp hóa chất, v.v.
- HCl (Axit Clohydric): Đây là dung dịch nước của khí hiđro clorua (HCl), không màu, có mùi chua, là một axit mạnh. Axit clohydric được sử dụng rộng rãi trong các quá trình công nghiệp, trong y học và trong đời sống hàng ngày.
- AlCl3 (Nhôm clorua): Là chất rắn kết tinh không màu ở nhiệt độ phòng. Nhôm clorua là một axit Lewis, được sử dụng trong nhiều ứng dụng hóa học như xử lý nước, lọc dầu, sản xuất nhôm, v.v.
- H2O (Nước): Là chất lỏng không màu, không mùi, là chất phổ biến và quan trọng trong tự nhiên và trong các quá trình công nghiệp.
Tiến trình phản ứng
Khi nhôm hiđroxit (Al(OH)3) và axit clohydric (HCl) được trộn lẫn với nhau, các phân tử sẽ tương tác và tạo thành sản phẩm mới, nhôm clorua (AlCl3) và nước (H2O). Phản ứng này có thể được mô tả bằng phương trình hóa học sau:
Al(OH)3 + HCl → AlCl3 + H2O
Trong phản ứng này, nhôm hiđroxit (Al(OH)3) đóng vai trò là chất oxi hóa (chất khử), còn axit clohydric (HCl) đóng vai trò là chất oxi hóa (chất oxi hóa). Sản phẩm của phản ứng là nhôm clorua (AlCl3) và nước (H2O).
Để cân bằng phương trình hóa học này, chúng ta cần xác định hệ số của các nguyên tố (Al, Cl, H, O) ở cả hai vế của phương trình sao cho tổng số nguyên tử của mỗi nguyên tố ở cả hai vế bằng nhau.
Vai trò của việc cân bằng phương trình hóa học là gì?
Cân bằng phương trình hóa học là một bước quan trọng trong việc mô tả và hiểu các quá trình hóa học. Nó có các vai trò chính sau:
1. Xác định đúng các sản phẩm của phản ứng
Khi cân bằng phương trình hóa học, chúng ta sẽ xác định chính xác các sản phẩm của phản ứng hóa học, đảm bảo tổng số nguyên tử của mỗi nguyên tố ở cả hai vế bằng nhau. Điều này giúp chúng ta hiểu rõ hơn về bản chất của phản ứng hóa học.
2. Tính toán định lượng sản phẩm
Từ phương trình cân bằng, chúng ta có thể tính toán định lượng các sản phẩm của phản ứng, ví dụ như khối lượng, thể tích hoặc số mol của sản phẩm. Điều này quan trọng trong các ứng dụng công nghiệp và phân tích hóa học.
3. Dự đoán hướng phản ứng
Phương trình cân bằng cung cấp thông tin về chất phản ứng và sản phẩm. Từ đó, chúng ta có thể dự đoán chiều hướng của phản ứng, xác định các yếu tố ảnh hưởng đến cân bằng và tối ưu hóa các điều kiện để đạt được hiệu suất phản ứng cao.
4. Tính toán các thông số nhiệt động lực học
Từ phương trình cân bằng, chúng ta có thể tính toán các thông số nhiệt động lực học như enthalpy phản ứng, entropy, năng lượng hoạt hóa, v.v. Các thông số này giúp chúng ta hiểu sâu hơn về cơ chế và động học của phản ứng hóa học.
5. Ứng dụng trong lĩnh vực khoa học và công nghiệp
Khả năng cân bằng phương trình hóa học là cơ sở cho việc nghiên cứu, phát triển và ứng dụng các quá trình hóa học trong nhiều lĩnh vực như hóa học, vật lý, sinh học, y học, kỹ thuật hóa học, v.v.
Do đó, việc cân bằng các phương trình hóa học, bao gồm phương trình Al(OH)3 + HCl → AlCl3 + H2O, là một kỹ năng cơ bản và quan trọng trong việc học và nghiên cứu hóa học.
Các bước cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O
Để cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O, chúng ta cần thực hiện các bước sau:
1. Xác định các yếu tố tham gia
Đầu tiên, chúng ta cần xác định các nguyên tố có trong phương trình, bao gồm: Al, H, O, Cl.
2. Viết các phương trình không cân bằng
Phương trình không cân bằng sẽ có dạng:
Al(OH)3 + HCl → AlCl3 + H2O
3. Cân bằng số nguyên tử của mỗi nguyên tố
- Cân bằng số nguyên tử Al:
- Bên trái có 1 nguyên tử Al
- Bên phải có 1 nguyên tử Al
- Nguyên tử Al cân bằng
- Cân bằng số nguyên tử Cl:
- Ở phía bên trái có 1 nguyên tử Cl
- Bên phải có 3 nguyên tử Cl
- Cần thêm 2 nguyên tử Cl vào vế trái
- Cân bằng số nguyên tử H:
- Ở phía bên trái có 3 nguyên tử H
- Bên phải có 2 nguyên tử H
- Cần loại bỏ 1 nguyên tử H ở phía bên trái
- Cân bằng số nguyên tử O:
- Ở phía bên trái có 3 nguyên tử O
- Bên phải có 1 nguyên tử O
- Cần loại bỏ 2 nguyên tử O ở phía bên trái
4. Viết phương trình cân bằng
Sau khi cân bằng số nguyên tử của mỗi nguyên tố, ta có phương trình cân bằng sau:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Lưu ý khi cân bằng phương trình Al(OH)3 + HCl → AlCl3 + H2O
Khi cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O, cần lưu ý những điểm sau:
1. Xác định chính xác những người tham gia
Trước khi cân bằng phương trình, cần xác định chính xác chất phản ứng (Al(OH)3, HCl) và sản phẩm tạo thành (AlCl3, H2O).
2. Cân bằng số nguyên tử của mỗi nguyên tố
Số lượng nguyên tử của mỗi nguyên tố (Al, Cl, H, O) phải được cân bằng ở cả hai vế của phương trình. Không bỏ sót bất kỳ nguyên tố nào.
3. Sử dụng hệ số thích hợp
Khi cân bằng phương trình, cần sử dụng hệ số thích hợp để làm cho số nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình bằng nhau.
4. Kiểm tra lại kết quả
Sau khi cân bằng phương trình, hãy kiểm tra kết quả để đảm bảo số nguyên tử của mỗi nguyên tố ở cả hai vế bằng nhau.
5. Hiểu bản chất của phản ứng
Ngoài việc cân bằng phương trình, cần phải hiểu rõ bản chất của phản ứng hóa học, vai trò của từng chất phản ứng và cơ chế của quá trình.
Thực hiện theo các lưu ý trên sẽ giúp bạn cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O một cách chính xác và hiệu quả.
Phương pháp cân bằng phương trình phản ứng Al(OH)3 + HCl → AlCl3 + H2O

Để cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O, ta có thể áp dụng các phương pháp sau:
1. Phương pháp tăng – giảm số hiệu nguyên tử
Bước 1: Xác định các nguyên tố xuất hiện trong phương trình. Bước 2: Viết phương trình không cân bằng. Bước 3: Cân bằng số nguyên tử của mỗi nguyên tố bằng cách tăng hoặc giảm hệ số thích hợp. Bước 4: Kiểm tra lại kết quả.
2. Phương pháp cân bằng chu trình electron
Bước 1: Xác định các nguyên tố liên quan và xác định số oxi hóa của chúng. Bước 2: Cân bằng số nguyên tử của nguyên tố oxy bằng cách thêm nước (H2O). Bước 3: Cân bằng số nguyên tử của nguyên tố hydro bằng cách thêm axit (HCl). Bước 4: Cân bằng số nguyên tử của các nguyên tố khác. Bước 5: Kiểm tra lại kết quả.
3. Phương pháp sử dụng hệ số thích hợp
Bước 1: Xác định các nguyên tố liên quan và đếm số nguyên tử của mỗi nguyên tố. Bước 2: Viết phương trình không cân bằng. Bước 3: Sử dụng hệ số thích hợp để cân bằng số nguyên tử của mỗi nguyên tố. Bước 4: Kiểm tra kết quả và điều chỉnh nếu cần.
4. Phương pháp sử dụng định luật bảo toàn nguyên tố
Bước 1: Xác định các nguyên tố tham gia phản ứng và các sản phẩm tạo thành trong phản ứng. Bước 2: Tạo bảng bảo toàn nguyên tố để xác định số nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình. Bước 3: Sử dụng hệ số thích hợp để cân bằng số nguyên tử của các nguyên tố. Bước 4: Kiểm tra kết quả và điều chỉnh nếu cần.
Việc áp dụng các phương pháp cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O sẽ giúp bạn hiểu được quá trình cân bằng và thực hiện phản ứng một cách chính xác.
Ví dụ cân bằng phương trình Al(OH)3 + HCl → AlCl3 + H2O
Để minh họa việc cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O, chúng ta sẽ thực hiện các bước sau:
- Xác định các nguyên tố tham gia: Al, H, O, Cl.
- Viết phương trình phản ứng không cân bằng: Al(OH)3 + HCl → AlCl3 + H2O.
- Cân bằng số nguyên tử của mỗi nguyên tố:
- Al: 1 nguyên tử ở cả hai vế.
- Cl: 1 nguyên tử ở vế trái, 3 nguyên tử ở vế phải.
- H: 3 nguyên tử ở bên trái, 2 nguyên tử ở bên phải.
- O: 3 nguyên tử ở bên trái, 1 nguyên tử ở bên phải.
- Viết phương trình cân bằng: Al(OH)3 + 3HCl → AlCl3 + 3H2O.
Qua ví dụ này, bạn có thể thấy cách cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O một cách chi tiết và hợp lý.
Ý nghĩa của việc cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O
Cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O có nhiều ý nghĩa quan trọng như:
1. Đảm bảo độ chính xác của phản ứng
Việc cân bằng phương trình giúp đảm bảo số nguyên tử của mỗi nguyên tố ở cả hai vế của phản ứng là bằng nhau, do đó đảm bảo tính chính xác của quá trình hóa học diễn ra.
2. Hiểu rõ hơn về quá trình phản ứng
Khi cân bằng phương trình, bạn sẽ hiểu rõ hơn về cơ chế và định luật phản ứng hóa học, từ đó nắm vững kiến thức lý thuyết và vận dụng vào thực tế.
3. Áp dụng vào thực tế
Cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O có thể ứng dụng trong nhiều lĩnh vực khác nhau như sản xuất hóa chất, công nghiệp, y học, nghiên cứu khoa học, v.v.
Ứng dụng cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O
Phương trình cân bằng hóa học Al(OH)3 + HCl → AlCl3 + H2O không chỉ là bài toán lý thuyết mà còn có nhiều ứng dụng thực tế như:
1. Trong công nghiệp hóa chất
Phương trình này có thể được áp dụng trong sản xuất hóa chất và xử lý chất thải để đảm bảo an toàn và hiệu quả.
2. Trong y học
Cân bằng phản ứng hóa học là cơ sở để hiểu và điều chỉnh các quá trình sinh học trong cơ thể, từ đó ứng dụng vào việc điều trị và chẩn đoán bệnh.
3. Trong nghiên cứu khoa học
Cân bằng phương trình hóa học là một bước quan trọng trong quá trình nghiên cứu và phát triển công nghệ mới, từ vật liệu đến dược phẩm.
Việc hiểu và áp dụng phương trình cân bằng hóa học Al(OH)3 + HCl → AlCl3 + H2O sẽ mang lại nhiều lợi ích và ứng dụng trong cuộc sống hàng ngày.
Tài liệu tham khảo về cân bằng phương trình Al(OH)3 + HCl → AlCl3 + H2O
- Atkins, P., & Jones, L. (2008). Nguyên lý hóa học: Cuộc tìm kiếm hiểu biết sâu sắc. WH Freeman và Công ty.
- Chang, R. (2010). Hóa học (ấn bản lần thứ 11). Khoa học/Kỹ thuật/Toán học McGraw-Hill.
- Ebbing, DD, & Gammon, SD (2016). Hóa học tổng quát. Cengage Learning.
Các tài liệu trên là nguồn thông tin đáng tin cậy để bạn tìm hiểu thêm về quá trình cân bằng phương trình hóa học và ứng dụng của nó trong thực tế.
Kết luận
Trên đây là tổng quan về quá trình cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O. Cân bằng phương trình không chỉ là kỹ năng cơ bản mà còn là nền tảng quan trọng trong việc học tập và nghiên cứu hóa học. Thông qua việc áp dụng các phương pháp cân bằng, bạn sẽ hiểu rõ hơn về quá trình phản ứng, ứng dụng vào nhiều lĩnh vực khác nhau và đóng góp vào sự phát triển của xã hội.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














