Định nghĩa phản ứng oxi hóa khử
Phản ứng oxi hóa khử là phản ứng trong đó số oxi hóa của các nguyên tử thay đổi. Số oxi hóa là điện tích của một nguyên tử giả sử tất cả các liên kết đều là liên kết ion.
Vai trò của chất oxi hóa và chất khử
Trong phản ứng oxi hóa khử, chất khử là chất nhường electron, chất oxi hóa là chất nhận electron. Quá trình oxi hóa là quá trình mất electron, quá trình khử là quá trình nhận electron.
Phản ứng giữa Fe và H2SO4 loãng
Phản ứng hóa học
Khi Fe phản ứng với H2SO4 loãng, phản ứng tạo ra FeSO4, H2 và nước. Đây là phản ứng oxi hóa khử, trong đó Fe đóng vai trò là chất khử và H+ đóng vai trò là chất oxi hóa.
Fe + H2SO4 → FeSO4 + H2↑
Cân bằng phản ứng
Để cân bằng phản ứng, chúng ta cần đảm bảo rằng số nguyên tử của mỗi nguyên tố ở vế trái bằng số nguyên tử của nguyên tố đó ở vế phải. Sau khi cân bằng, phản ứng trở thành:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3H2↑ + 6H2O
Phản ứng giữa Fe và H2SO4 cô đặc lạnh

Phản ứng hóa học
Khi Fe phản ứng với H2SO4 đặc lạnh, phản ứng sẽ tạo ra Fe2(SO4)3 và SO2. Đây cũng là phản ứng oxi hóa khử, trong đó Fe đóng vai trò là chất khử và S đóng vai trò là chất oxi hóa.
2Fe + 6H2SO4 (cô đặc, lạnh) → Fe2(SO4)3 + 3SO2↑ + 6H2O
Cân bằng phản ứng
Sau khi cân bằng, phản ứng trở thành:
2Fe + 6H2SO4 (cô đặc, lạnh) → Fe2(SO4)3 + 3SO2↑ + 6H2O
Phản ứng giữa Fe và H2SO4 đặc nóng
Phản ứng hóa học
Khi Fe phản ứng với H2SO4 đặc nóng, phản ứng tạo ra Fe2(SO4)3, SO2 và H2O. Đây cũng là phản ứng oxi hóa khử, trong đó Fe đóng vai trò là chất khử và S đóng vai trò là chất oxi hóa. Tuy nhiên, khi đun nóng, phản ứng tạo ra thêm khí H2S và S.
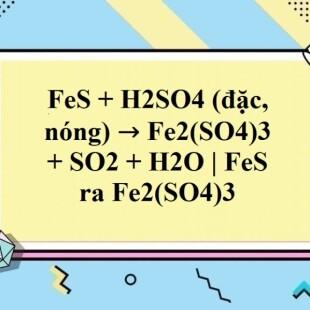
2Fe + 6H2SO4 (đặc, nóng) → Fe2(SO4)3 + 3SO2↑ + 2H2S↑ + 2H2O
Cân bằng phản ứng
Sau khi cân bằng, phản ứng trở thành:
2Fe + 6H2SO4 (đặc, nóng) → Fe2(SO4)3 + 3SO2↑ + H2S↑ + 5H2O
Cân bằng phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Để cân bằng phản ứng, chúng ta cần đảm bảo rằng số nguyên tử của mỗi nguyên tố ở vế trái bằng số nguyên tử của nguyên tố đó ở vế phải. Chúng ta có thể thực hiện điều này bằng cách sử dụng phương pháp cân bằng ion-electron.
Bước 1: Xác định số oxi hóa của các nguyên tử
| Nguyên tử | Số oxi hóa |
|---|---|
| Fe | 0 |
| S | +6 |
| H | +1 |
| Ồ | -2 |
Bước 2: Xác định chất khử và chất oxi hóa
Chất khử là Fe, vì số oxi hóa của Fe tăng từ 0 đến +3. Chất oxi hóa là S, vì số oxi hóa của S giảm từ +6 đến +4.
Bước 3: Viết các phản ứng oxi hóa và khử
Phản ứng oxi hóa bán phần:
Fe → Fe3+ + 3e-
Phản ứng nửa khử:
S6+ + 2e- → S4+
Bước 4: Cân bằng nửa phản ứng
Cần phải cân bằng số nguyên tử của mỗi nguyên tố và số điện tích ở cả hai vế của mỗi nửa phản ứng.
Phản ứng oxi hóa bán phần:
2Fe → 2Fe3+ + 6e-
Phản ứng nửa khử:
S6+ + 4e- → 3S4+
Bước 5: Nhân nửa phản ứng với hệ số thích hợp
Nhân nửa phản ứng oxi hóa với hệ số 3 và nửa phản ứng khử với hệ số 2 để cân bằng số electron được chuyển đi.
Phản ứng oxi hóa bán phần (ba):
6Fe → 6Fe3+ + 18e-
Phản ứng khử một nửa (nhân 2):
2S6+ + 8e- → 6S4+
Bước 6: Thêm hai nửa phản ứng
Cộng hai phản ứng nửa đã nhân lại với nhau, sau đó loại bỏ các electron ở cả hai vế.
6Fe + 2S6+ → 6Fe3+ + 6S4+
Bước 7: Thêm ion H+ và H2O để cân bằng phản ứng
Thêm các ion H+ và H2O vào phía thích hợp để cân bằng số nguyên tử H và O.
6Fe + 2S6+ + 18H+ → 6Fe3+ + 6S4+ + 9H2O
Bước 8: Kiểm tra lại phản ứng cân bằng
Kiểm tra số nguyên tử của mỗi nguyên tố và số điện tích ở cả hai vế của phản ứng để đảm bảo phản ứng cân bằng.
6Fe + 2S6+ + 18H+ → 6Fe3+ + 6S4+ + 9H2O
Phản ứng cân bằng:
6Fe + 2H2SO4 (đặc, nóng) → Fe2(SO4)3 + 3SO2↑ + H2S↑ + 5H2O
Kết luận
Phản ứng giữa Fe và H2SO4 là phản ứng oxi hóa khử, trong đó Fe đóng vai trò là chất khử và H+ hoặc S đóng vai trò là chất oxi hóa. Tùy thuộc vào điều kiện phản ứng (nồng độ H2SO4, nhiệt độ), phản ứng sẽ tạo ra các sản phẩm khác nhau. Cân bằng phản ứng hóa học là điều quan trọng để đảm bảo rằng số nguyên tử của mỗi nguyên tố ở vế trái bằng số nguyên tử của nguyên tố đó ở vế phải. Sử dụng phương pháp cân bằng ion-electron là một trong những cách hiệu quả để cân bằng phản ứng hóa học.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














