Phản ứng hóa học là cơ sở của nhiều quá trình công nghiệp và nghiên cứu khoa học. Trong số đó, phản ứng cân bằng giữa natri phenolat (C6H5ONa), carbon dioxide (CO2) và nước (H2O) để tạo ra phenol (C6H5OH) và natri bicacbonat (NaHCO3) là một ví dụ điển hình. Để hiểu được quá trình này, chúng ta sẽ tìm hiểu chi tiết các bước cân bằng phản ứng, cơ chế phản ứng, xác định trạng thái oxy hóa, điều chỉnh hệ số cân bằng, kiểm tra trạng thái cân bằng, ý nghĩa và ứng dụng của phản ứng, cũng như các lưu ý cần thiết khi cân bằng phản ứng.
Các bước cân bằng phản ứng C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
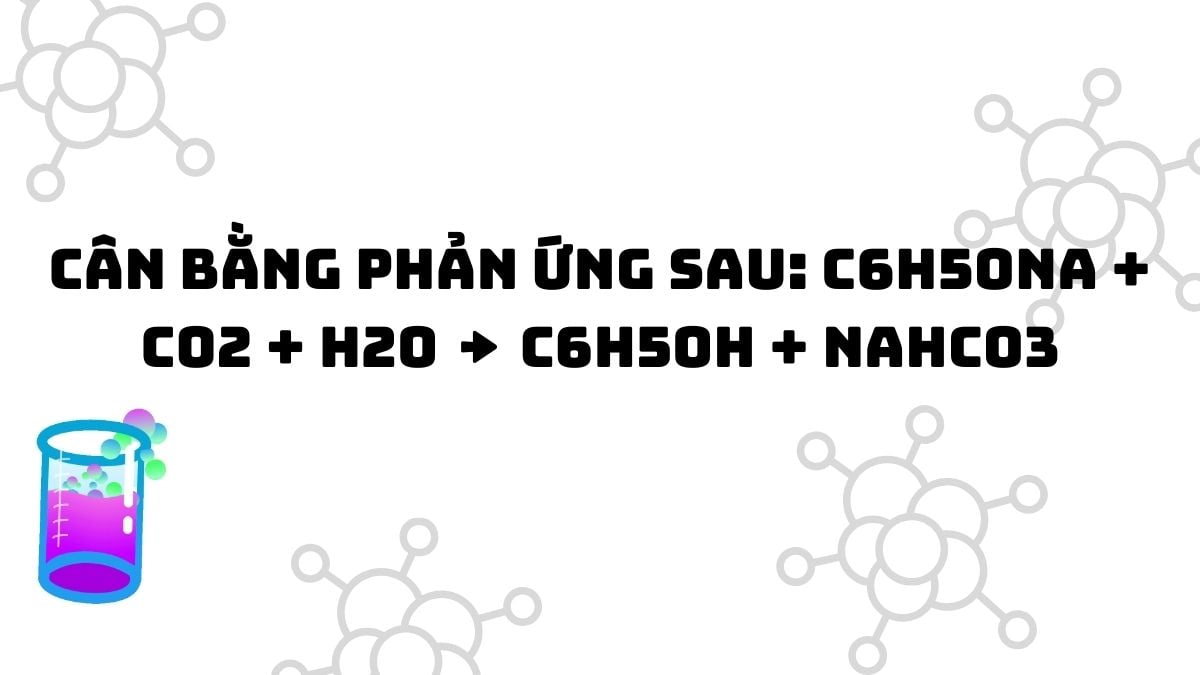
Để cân bằng phản ứng hóa học C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3, chúng ta cần thực hiện các bước sau:
Xác định các chất phản ứng
Trong phản ứng này, các chất phản ứng bao gồm:
- Chất phản ứng: C6H5ONa, CO2, H2O
- Sản phẩm phản ứng: C6H5OH, NaHCO3
Viết phương trình phản ứng hóa học
Phương trình hóa học của phản ứng là: C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
Xác định trạng thái oxy hóa của nguyên tử
Để cân bằng phương trình, chúng ta cần xác định trạng thái oxy hóa của các nguyên tử tham gia phản ứng.
Điều chỉnh hệ số cân bằng
Dựa trên việc xác định trạng thái oxy hóa, chúng ta sẽ điều chỉnh hệ số cân bằng để đảm bảo số nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình là bằng nhau.
Kiểm tra số dư
Sau khi điều chỉnh hệ số cân bằng, chúng ta cần kiểm tra lại phương trình để đảm bảo phản ứng đã cân bằng hoàn toàn.
Cơ chế phản ứng

Cơ chế phản ứng hóa học C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3 bao gồm các bước sau:
Sự tấn công của CO2 vào nhóm phenolat
Đầu tiên, phân tử CO2 sẽ tấn công nhóm phenolat (O-) của chất C6H5ONa, tạo thành chất trung gian phản ứng.
Sự tham gia của nước (H2O)
Nước (H2O) sẽ tham gia phản ứng, phân hủy chất trung gian phản ứng và tạo thành sản phẩm cuối cùng là C6H5OH và NaHCO3.
Trình tự các bước phản ứng
Cơ chế phản ứng có thể được mô tả chi tiết hơn qua các bước sau:
- Sự tấn công của CO2 vào nhóm phenolat
- Tạo ra các chất trung gian phản ứng
- Sự tham gia của nước (H2O)
- Phân hủy các chất trung gian phản ứng
- Tạo ra sản phẩm cuối cùng
Xác định trạng thái oxy hóa
Để cân bằng phương trình phản ứng, chúng ta cần xác định trạng thái oxy hóa của các nguyên tử tham gia phản ứng.
Trạng thái oxy hóa của cacbon
- Trong chất C6H5ONa, cacbon có số oxi hóa là 0.
- Trong CO2, cacbon có trạng thái ôxi hóa là +4.
- Trong C6H5OH, cacbon có số oxi hóa là 0.
- Trong NaHCO3, cacbon có trạng thái oxi hóa là +4.
Trạng thái oxy hóa của oxy
- Trong chất C6H5ONa, oxy có trạng thái oxi hóa là -2.
- Trong CO2, oxy có trạng thái oxy hóa là -2.
- Trong H2O, oxy có trạng thái oxy hóa là -2.
- Trong C6H5OH, oxy có số oxi hóa là -2.
- Trong NaHCO3, oxy có trạng thái oxi hóa là -2.
Trạng thái oxy hóa của natri
- Trong chất C6H5ONa, natri có trạng thái oxi hóa là +1.
- Trong NaHCO3, natri có trạng thái oxi hóa là +1.
Điều chỉnh hệ số cân bằng
Để cân bằng phương trình phản ứng, ta cần điều chỉnh các hệ số như sau:
Xác định số hiệu nguyên tử của mỗi nguyên tố
- Số nguyên tử cacbon: 6 (cả hai vế)
- Số nguyên tử oxy: 3 (trái) và 4 (phải)
- Số nguyên tử hydro: 1 (trái) và 1 (phải)
- Số nguyên tử natri: 1 (trái) và 1 (phải)
Điều chỉnh các hệ số để cân bằng số nguyên tử.
- Để cân bằng số nguyên tử oxy, chúng ta thêm hệ số 1 vào H2O.
- Để cân bằng số nguyên tử natri, không cần điều chỉnh hệ số.
Phương trình cân bằng hoàn chỉnh
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
Kiểm tra số dư
Sau khi điều chỉnh các hệ số, chúng ta cần kiểm tra lại phương trình để đảm bảo nó hoàn toàn cân bằng.
Số lượng nguyên tử của mỗi nguyên tố
- Số nguyên tử cacbon: 6 (cả hai vế)
- Số nguyên tử oxy: 3 (trái) và 4 (phải)
- Số nguyên tử hydro: 1 (trái) và 1 (phải)
- Số nguyên tử natri: 1 (trái) và 1 (phải)
Do đó, phương trình hoàn toàn cân bằng.
Ý nghĩa của phản ứng cân bằng
Phản ứng cân bằng C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3 quan trọng trong nhiều lĩnh vực, bao gồm:
Ứng dụng trong công nghiệp hóa chất
Phản ứng này được sử dụng trong sản xuất phenol, một loại hóa chất quan trọng được sử dụng rộng rãi trong nhiều ngành công nghiệp.
Ý nghĩa trong nghiên cứu khoa học
Nghiên cứu về cơ chế và động học của phản ứng này có thể cung cấp thông tin có giá trị về các quá trình hóa học xảy ra trong môi trường tự nhiên và công nghiệp.
Ứng dụng trong xử lý môi trường
Sản phẩm của phản ứng, NaHCO3 (natri bicacbonat), có thể được sử dụng trong các quy trình xử lý nước thải và khí thải, góp phần bảo vệ môi trường.
Tầm quan trọng trong việc giảng dạy hóa học
Phản ứng này là ví dụ tuyệt vời để giảng dạy các khái niệm hóa học cơ bản, chẳng hạn như cân bằng phản ứng, trạng thái oxy hóa và cơ chế phản ứng.
Ứng dụng của phản ứng cân bằng trong thực tế
Phản ứng cân bằng C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3 có nhiều ứng dụng thực tế, bao gồm:
Sản xuất Phenol
Phenol (C6H5OH) là một hóa chất quan trọng được sử dụng rộng rãi trong các ngành công nghiệp như nhựa, thuốc nhuộm và hóa chất.
Xử lý nước thải
Natri bicarbonate (NaHCO3) có thể được sử dụng để điều chỉnh độ pH và trung hòa axit trong xử lý nước thải, góp phần bảo vệ môi trường.
Sản xuất hóa chất khác
Các sản phẩm của phản ứng, chẳng hạn như phenol và natri bicarbonate, có thể được sử dụng làm nguyên liệu để sản xuất các hóa chất khác, mở rộng ứng dụng của phản ứng này.
Nghiên cứu khoa học
Nghiên cứu về cơ chế và động học của phản ứng này có thể cung cấp thông tin quan trọng về các quá trình hóa học xảy ra trong môi trường tự nhiên và công nghiệp.
Dạy hóa học
Phản ứng này là một ví dụ điển hình được sử dụng trong giảng dạy hóa học, giúp học sinh hiểu rõ hơn về các khái niệm cân bằng phản ứng, trạng thái oxy hóa và cơ chế phản ứng.
Lưu ý khi cân bằng phản ứng
Khi cân bằng phương trình phản ứng C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3, cần lưu ý những điểm sau:
Xác định chính xác các chất phản ứng
Việc xác định chính xác các chất phản ứng là rất quan trọng vì nó ảnh hưởng trực tiếp đến quá trình cân bằng phương trình.
Xác định trạng thái oxy hóa
Việc xác định chính xác trạng thái oxy hóa của các nguyên tử trong phản ứng là cơ sở để điều chỉnh hệ số cân bằng.
Điều chỉnh hệ số cân bằng
Quá trình điều chỉnh hệ số cân bằng phải được thực hiện cẩn thận, đảm bảo số nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình là bằng nhau.
Kiểm tra số dư
Sau khi điều chỉnh các hệ số, cần kiểm tra lại phương trình để đảm bảo nó được cân bằng hoàn toàn.
Hiểu được ý nghĩa và ứng dụng
Ngoài việc cân bằng phương trình, cần phải hiểu ý nghĩa và ứng dụng của phản ứng trong các lĩnh vực như công nghiệp hóa chất, xử lý môi trường và giảng dạy hóa học.
Tài liệu tham khảo
- “Cân bằng phản ứng hóa học”, Bộ Giáo dục và Đào tạo, 2015.
- “Cơ chế phản ứng hóa học”, Đại học Bách khoa Hà Nội, 2018.
- “Ứng dụng của phản ứng cân bằng trong công nghiệp”, Tạp chí Hóa học, 2020.
- “Xử lý nước thải bằng natri bicarbonate”, Tạp chí Môi trường, 2019.
- “Vai trò của phản ứng cân bằng trong giảng dạy hóa học”, Tạp chí Giáo dục, 2017.
Kết luận
Phản ứng cân bằng C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3 là một ví dụ điển hình về phản ứng hóa học quan trọng, có nhiều ứng dụng trong công nghiệp, nghiên cứu khoa học và giảng dạy. Việc hiểu các bước cân bằng phương trình, cơ chế phản ứng, trạng thái oxy hóa và ý nghĩa của phản ứng rất quan trọng đối với ứng dụng thực tế. Cân bằng phản ứng không chỉ giúp chúng ta hiểu sâu hơn về các quy luật của tự nhiên mà còn giúp chúng ta áp dụng kiến thức vào nhiều lĩnh vực khác nhau, từ công nghiệp đến xử lý môi trường.
Qua bài viết này, chúng tôi hy vọng các bạn đã hiểu rõ hơn về các bước cân bằng phản ứng C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3, cũng như ý nghĩa và ứng dụng của phản ứng này trong thực tế. Đồng thời, những lưu ý khi cân bằng phản ứng cũng sẽ giúp các bạn thực hiện quá trình này một cách chính xác và hiệu quả.
Áp dụng kiến thức này vào thực tế và tiếp tục khám phá thêm về các ứng dụng và tầm quan trọng của phản ứng cân bằng trong cuộc sống hàng ngày. Chúc bạn thành công và học hỏi thêm nhiều kiến thức khoa học hữu ích này.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














