Phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3) tạo thành nhôm oxit (Al2O3) và sắt (Fe) là một ví dụ điển hình về cân bằng hóa học. Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về phản ứng này, bao gồm các chất phản ứng, sản phẩm, cách cân bằng phương trình hóa học, vai trò của chất xúc tác, điều kiện phản ứng và ứng dụng thực tế.
Phản ứng đầu tiên

Phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3) để tạo thành nhôm oxit (Al2O3) và sắt (Fe) được gọi là phản ứng thermite hoặc phản ứng thermite ferro-nhôm. Phản ứng này được sử dụng rộng rãi trong công nghiệp, đặc biệt là trong luyện kim và sản xuất các sản phẩm nhôm và thép.
Tổng quan về phản ứng
Phản ứng này xảy ra khi nhôm, một kim loại khử mạnh, phản ứng với oxit sắt (III), một oxit kim loại, để tạo thành oxit nhôm và sắt. Quá trình này được gọi là phản ứng nhiệt nhôm vì nó giải phóng một lượng nhiệt lớn, có thể đạt tới nhiệt độ lên tới 2500°C.
Sự hình thành sản phẩm
Trong phản ứng này, nhôm khử sắt(III) oxit, tạo thành nhôm oxit và sắt kim loại. Phản ứng xảy ra theo các bước sau:
- Nhôm (Al) bị oxy hóa, chuyển từ trạng thái kim loại sang trạng thái oxit (Al2O3).
- Sắt (Fe) trong sắt (III) oxit (Fe2O3) bị khử, chuyển thành dạng kim loại.
Kết quả thu được hai sản phẩm chính: nhôm oxit (Al2O3) và sắt (Fe).
Chất phản ứng
Trong phản ứng cân bằng Al + Fe2O3 → Al2O3 + Fe, có hai chất phản ứng là nhôm (Al) và sắt (III) oxit (Fe2O3).
Nhôm (Al)
Nhôm là kim loại màu trắng bạc, mềm, dễ uốn và dễ kéo sợi. Số nguyên tử của nó là 13 và ký hiệu hóa học của nó là Al. Nhôm là kim loại rất dễ phản ứng, dễ tham gia vào các phản ứng oxy hóa khử.
Trong phản ứng này, nhôm đóng vai trò là chất khử, cung cấp electron để khử sắt (III) oxit (Fe2O3).
Sắt (III) oxit (Fe2O3)
Sắt (III) oxit, còn được gọi là hematit, là một hợp chất vô cơ có công thức hóa học Fe2O3. Đây là chất rắn màu nâu đỏ, thường được tìm thấy trong tự nhiên dưới dạng khoáng chất.
Trong phản ứng này, sắt (III) oxit đóng vai trò là chất khử, nhận electron từ nhôm để chuyển thành sắt kim loại.
Sản phẩm phản ứng
Kết quả của phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3) là tạo ra hai sản phẩm chính: nhôm oxit (Al2O3) và sắt (Fe).
Nhôm oxit (Al2O3)
Nhôm oxit, còn được gọi là nhômlà một hợp chất vô cơ có công thức hóa học là Al2O3. Đây là một chất rắn màu trắng, cứng, chịu nhiệt. Nhôm oxit được sử dụng rộng rãi trong nhiều lĩnh vực, từ công nghiệp đến y học.
Trong phản ứng này, nhôm oxit được hình thành khi nhôm chuyển từ trạng thái kim loại sang trạng thái oxit.
Sắt (Fe)
Sắt là một kim loại màu xám, cứng và có độ dẻo cao. Đây là một trong những kim loại phổ biến nhất trên Trái Đất và có nhiều ứng dụng công nghiệp quan trọng.
Trong phản ứng, sắt được hình thành khi sắt (III) oxit bị khử bởi nhôm, chuyển từ trạng thái oxit sang trạng thái kim loại.
Cân bằng phương trình phản ứng
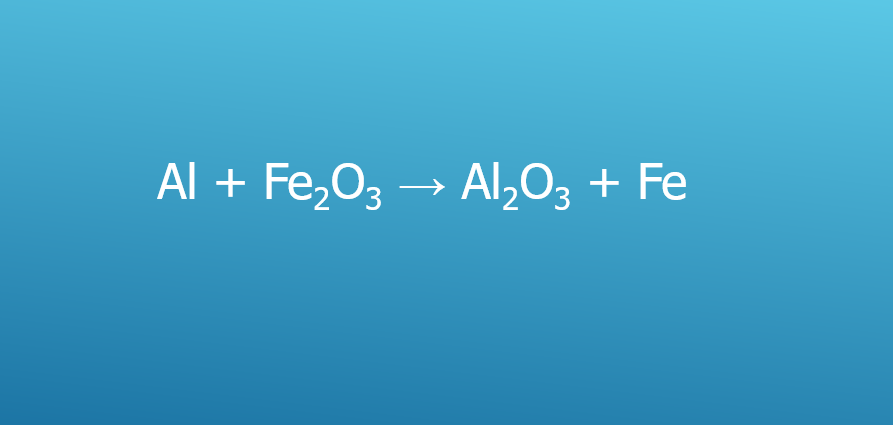
Để cân bằng phương trình phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3), chúng ta cần xác định hệ số của chất phản ứng và sản phẩm.
Phương trình phản ứng không cân bằng
Phương trình phản ứng không cân bằng ban đầu có dạng:
Al + Fe2O3 → Al2O3 + Fe
Cân bằng phương trình phản ứng
Để cân bằng phương trình, chúng ta cần cân bằng số nguyên tử của các nguyên tố:
- Cân bằng nguyên tử Al: 2Al → Al2O3
- Cân bằng nguyên tử Fe: 2Fe
- Cân bằng các nguyên tử O: 3O → Al2O3
Kết quả là phương trình phản ứng cân bằng như sau:
2Al + Fe2O3 → Al2O3 + 2Fe
Phương trình phản ứng cân bằng
Phương trình phản ứng cân bằng giữa nhôm (Al) và sắt (III) oxit (Fe2O3) có dạng:
2Al + Fe2O3 → Al2O3 + 2Fe
Trong đó:
- 2Al là lượng nhôm tham gia phản ứng.
- Fe2O3 là lượng sắt (III) oxit tham gia phản ứng.
- Al2O3 là lượng nhôm oxit được tạo thành.
- 2Fe là lượng sắt kim loại được tạo thành.
Phương trình này thể hiện đầy đủ sự cân bằng số nguyên tử của các nguyên tố tham gia.
Phương pháp cân bằng phản ứng
Để cân bằng phương trình phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3), có thể sử dụng một số phương pháp sau:
Phương pháp thử và sai
Đây là phương pháp đơn giản nhất, bắt đầu bằng cách thiết lập hệ số cho chất phản ứng và sản phẩm, sau đó kiểm tra xem phương trình có cân bằng về mặt nguyên tử của các nguyên tố hay không. Nếu không, hãy tiếp tục điều chỉnh hệ số cho đến khi đạt được sự cân bằng.
Phương pháp ion-electron
Phương pháp ion-electron dựa trên việc tách phản ứng thành các nửa phản ứng oxi hóa và khử, sau đó cân bằng số electron trao đổi giữa hai nửa phản ứng.
Phương pháp số oxi hóa khử
Phương pháp số oxi hóa – khử dựa trên việc xác định số oxi hóa của các nguyên tử trong chất phản ứng và sản phẩm, sau đó cân bằng số electron trao đổi.
Bất kể sử dụng phương pháp nào, mục đích là cân bằng phương trình phản ứng để đảm bảo tính đúng đắn và chính xác.
Vai trò xúc tác
Trong phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3), việc sử dụng chất xúc tác có thể giúp tăng tốc độ phản ứng và cải thiện hiệu suất.
Chất xúc tác oxit kim loại
Các oxit kim loại như crom(III) oxit (Cr2O3) hoặc molypden(VI) oxit (MoO3) có thể được sử dụng làm chất xúc tác cho phản ứng này. Các oxit này giúp tăng tốc phản ứng bằng cách cung cấp các vị trí hoạt động để khử sắt(III) oxit.
Chất xúc tác than hoạt tính
Than hoạt tính cũng là chất xúc tác hiệu quả cho phản ứng này. Than hoạt tính có diện tích bề mặt lớn, làm tăng tiếp xúc giữa các chất phản ứng, do đó làm tăng tốc độ phản ứng.
Tác dụng của chất xúc tác
Sử dụng chất xúc tác có thể giúp giảm nhiệt độ phản ứng cần thiết, tăng tốc độ phản ứng và cải thiện hiệu quả của quá trình. Điều này rất quan trọng trong các ứng dụng công nghiệp của phản ứng này.
Điều kiện phản ứng
Để phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3) xảy ra hiệu quả, cần đảm bảo các điều kiện phản ứng thích hợp.
Nhiệt độ phản ứng
Phản ứng này thường diễn ra ở nhiệt độ cao, thường là 1000°C trở lên. Nhiệt độ càng cao, tốc độ phản ứng càng nhanh và sản lượng càng cao.
Kích thước hạt
Kích thước hạt của chất phản ứng cũng ảnh hưởng đến tốc độ và hiệu quả của phản ứng. Các hạt nhỏ hơn có diện tích bề mặt lớn hơn, giúp tăng tốc phản ứng.
Trộn đều
Việc trộn đều các chất phản ứng cũng rất quan trọng, giúp tăng cường tiếp xúc giữa chúng và do đó tăng tốc độ phản ứng.
Áp suất phản ứng
Phản ứng này thường được thực hiện ở áp suất bình thường. Tuy nhiên, việc tăng áp suất có thể giúp tăng hiệu suất phản ứng.
Việc kiểm soát và điều chỉnh các điều kiện phản ứng là rất quan trọng để đạt được tốc độ và hiệu suất phản ứng tối ưu.
Ứng dụng của phản ứng cân bằng
Phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3) có nhiều ứng dụng quan trọng trong công nghiệp và đời sống.
Sản xuất nhôm
Phản ứng này được sử dụng trong quá trình nấu chảy nhôm. Nhôm oxit (Al2O3) được tạo ra từ phản ứng này là nguyên liệu chính để sản xuất nhôm bằng phương pháp điện phân nóng chảy.
Sản xuất thép
Sắt (Fe) thu được từ phản ứng này có thể được sử dụng làm nguyên liệu để sản xuất thép, một trong những vật liệu quan trọng nhất trong công nghiệp.
Công nghệ hàn cắt kim loại
Phản ứng nhiệt nhôm cũng được sử dụng trong công nghệ hàn và cắt kim loại. Lượng nhiệt lớn tỏa ra trong phản ứng này có thể được sử dụng để làm nóng chảy và hàn kim loại.
Khai khoáng và luyện kim
Phản ứng này cũng được sử dụng trong khai thác và luyện kim quặng sắt và nhôm từ tài nguyên thiên nhiên.
Sản xuất nhiên liệu rắn
Hỗn hợp nhôm và sắt (III) oxit cũng được sử dụng để sản xuất nhiên liệu rắn cho các ứng dụng quân sự và hàng không vũ trụ.
Với nhiều ứng dụng quan trọng, phản ứng giữa nhôm và sắt (III) oxit đóng vai trò thiết yếu trong nhiều lĩnh vực khác nhau của đời sống và công nghiệp.
Kết luận
Trong bài viết này, chúng ta đã tìm hiểu về phản ứng giữa nhôm (Al) và sắt (III) oxit (Fe2O3), từ phản ứng ban đầu, chất phản ứng, sản phẩm phản ứng đến cân bằng phương trình phản ứng. Chúng ta cũng đã đi sâu vào các phương pháp cân bằng phản ứng, vai trò của chất xúc tác, điều kiện phản ứng và ứng dụng của phản ứng cân bằng.
Phản ứng giữa nhôm và sắt (III) oxit không chỉ là phản ứng hóa học đơn giản mà còn có nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Việc hiểu được phản ứng này không chỉ giúp chúng ta nắm vững kiến thức hóa học mà còn giúp chúng ta vận dụng hiệu quả vào thực tế.
Hy vọng bài viết này đã cung cấp cho bạn cái nhìn tổng quan chi tiết về phản ứng giữa nhôm và sắt (III) oxit, giúp bạn hiểu rõ hơn về quá trình này và ứng dụng của nó trong cuộc sống hàng ngày. Hãy cùng vận dụng kiến thức này vào thực tế để tận dụng tối đa những lợi ích mà phản ứng này mang lại.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!
- Cách ăn hạt óc chó đa dạng mang đến trải nghiệm thú vị
- Cách vẽ biểu đồ đường đẹp chính xác 10 điểm quá đơn giản
- Các loại hàng hóa, dịch vụ không được giảm thuế GTGT xuống 8% từ ngày 01/01/2024 theo Nghị định 94/2023/NĐ-CP
- Tiêm HPV là gì?
- Tài khoản Nhaccuatui VIP miễn phí 2024, Cho Acc Nhaccuatui VIP












