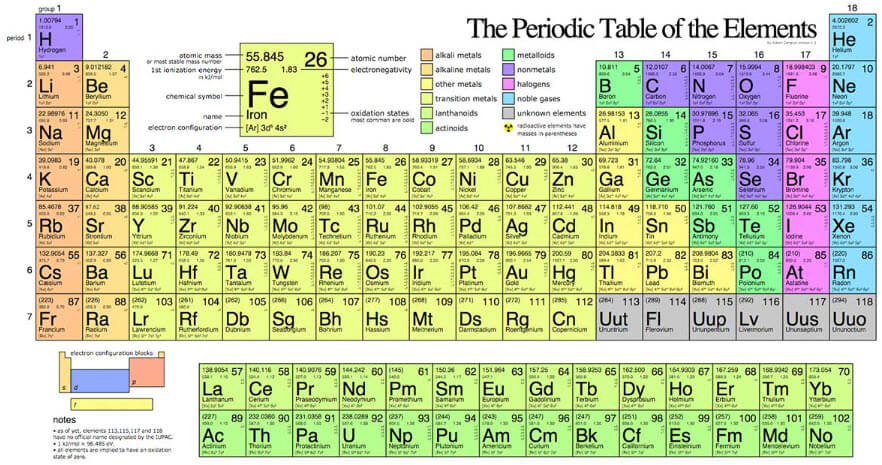
Bảng tuần hoàn là một biểu đồ hệ thống sắp xếp các nguyên tố hóa học theo số hiệu nguyên tử, cấu hình electron và tính chất hóa học tuần hoàn. Nó được coi là một công cụ mạnh mẽ cho hóa học vì nó cung cấp thông tin toàn diện về các nguyên tố và tạo điều kiện cho việc dự đoán hành vi hóa học của chúng. Bài viết này sẽ khám phá nhiều khía cạnh khác nhau của bảng tuần hoàn, bao gồm lịch sử, cấu trúc, xu hướng tính chất và ứng dụng của nó.
Lịch sử phát triển của Bảng tuần hoàn
Johann Wolfgang Dobereiner (1780-1849)
Johann Wolfgang Dobereiner, một nhà hóa học người Đức, là người đầu tiên nhận ra mối quan hệ giữa khối lượng nguyên tử và tính chất của các nguyên tố. Ông sắp xếp ba nguyên tố Li, Na và K thành một bộ ba theo thứ tự khối lượng nguyên tử tăng dần. Ông phát hiện ra rằng khối lượng nguyên tử của nguyên tố thứ hai (Na) gần bằng khối lượng nguyên tử trung bình của nguyên tố thứ nhất (Li) và nguyên tố thứ ba (K).
John Newlands (1838-1898)
John Newlands, một nhà hóa học người Anh, cũng sắp xếp các nguyên tố theo thứ tự khối lượng nguyên tử tăng dần. Ông quan sát thấy một mô hình tính chất hóa học lặp lại sau mỗi tám nguyên tố. Ông sắp xếp các nguyên tố thành các nhóm tám, được gọi là “luật bát phân”. Tuy nhiên, luật này không áp dụng cho tất cả các nguyên tố.
Dmitri Mendeleev (1834-1907)
Dmitri Mendeleev, một nhà hóa học người Nga, được công nhận rộng rãi là cha đẻ của bảng tuần hoàn hiện đại. Ông sắp xếp các nguyên tố theo khối lượng nguyên tử tăng dần và các tính chất hóa học tương tự. Khi một số nguyên tố không phù hợp với thứ tự này, Mendeleev để lại những chỗ trống trên bảng của mình, dự đoán rằng chúng sẽ đại diện cho các nguyên tố chưa được khám phá. Những dự đoán của Mendeleev sau đó đã được chứng minh là đúng.
Cấu trúc của bảng tuần hoàn
Hàng và cột
Bảng tuần hoàn gồm 18 cột dọc (nhóm) và 7 hàng ngang (chu kỳ). Các nhóm được đánh số từ 1 đến 18 từ trái sang phải. Các chu kỳ được đánh số từ 1 đến 7 từ trên xuống dưới.
Kim loại, phi kim loại và khí hiếm
Các nguyên tố trong bảng tuần hoàn được chia thành ba loại chính: kim loại, phi kim và khí hiếm. Kim loại có độ bóng, dễ uốn và dễ kéo sợi. Phi kim thì cùn, giòn và không dẫn điện. Khí hiếm là hợp chất không hoạt động tồn tại dưới dạng các phân tử đơn nguyên tử.
Xu hướng tính cách
Nhiều tính chất của các nguyên tố, chẳng hạn như trạng thái vật lý, độ dẫn điện và khả năng phản ứng với nước, thể hiện xu hướng thay đổi theo vị trí của chúng trong bảng tuần hoàn.
Khối S, P, D và F
Các nguyên tố trong nhóm 1A đến 2A được gọi là các nguyên tố khối s vì các electron hóa trị của chúng nằm trong lớp s. Các nguyên tố trong nhóm 3A đến 6A được gọi là các nguyên tố khối p vì các electron hóa trị của chúng nằm trong lớp p. Các nguyên tố trong nhóm 3B đến 8B được gọi là các nguyên tố khối d vì các electron hóa trị của chúng nằm trong lớp d. Các nguyên tố trong nhóm 17A được gọi là các nguyên tố khối f vì các electron hóa trị của chúng nằm trong lớp f.
Xu hướng tính chất trong bảng tuần hoàn
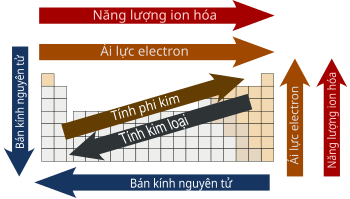
Bán kính nguyên tử
Bán kính nguyên tử tăng dần từ trên xuống dưới trong một nhóm và giảm dần từ trái sang phải trong một chu kỳ. Điều này là do sự bổ sung các lớp electron khi bạn đi xuống một nhóm và sự giảm dần của sự lấp đầy electron khi bạn đi từ trái sang phải trong một chu kỳ.
Hóa trị của electron
Electron hóa trị là số electron ở lớp ngoài cùng của một nguyên tố. Nó quyết định tính chất hóa học của nguyên tố. Số nhóm của một nguyên tố tương ứng với các electron hóa trị của nguyên tố đó.
Tính chất kim loại và phi kim loại
Tính kim loại tăng dần từ trên xuống dưới trong một nhóm và giảm dần từ trái sang phải trong một chu kỳ. Điều này thể hiện ở phản ứng với nước, trong đó kim loại giữ vị trí hoạt động và tạo thành bazơ, trong khi phi kim giữ vị trí thụ động và tạo thành axit.
Độ âm điện
Độ âm điện là xu hướng của một nguyên tử thu hút electron. Nó tăng dần từ dưới lên trên trong một nhóm và giảm dần từ trái sang phải trong một chu kỳ. Các nguyên tố có độ âm điện cao hơn sẽ thu hút electron mạnh hơn các nguyên tố có độ âm điện thấp hơn.
Ứng dụng của Bảng tuần hoàn
Dự đoán tính chất hóa học
Bảng tuần hoàn cho phép các nhà hóa học dự đoán tính chất hóa học của các nguyên tố dựa trên vị trí của chúng trong bảng. Ví dụ, các nguyên tố trong cùng một nhóm có cùng số electron hóa trị và do đó có tính chất hóa học tương tự nhau.
Sự sắp xếp các yếu tố
Bảng tuần hoàn là công cụ sắp xếp các nguyên tố theo cách có hệ thống. Nó giúp các nhà khoa học dễ dàng tìm và so sánh các nguyên tố có tính chất tương tự.
Phát hiện xu hướng trong các thuộc tính
Bảng tuần hoàn nêu bật xu hướng về tính chất của các nguyên tố, chẳng hạn như tính kim loại, tính phi kim và độ âm điện. Những xu hướng này có giá trị trong việc hiểu các phản ứng hóa học và thiết kế vật liệu mới.
Bản tóm tắt
Bảng tuần hoàn là một công cụ vô cùng hữu ích trong hóa học. Nó cung cấp thông tin toàn diện về các nguyên tố, cho phép các nhà khoa học dự đoán tính chất hóa học của chúng, sắp xếp chúng một cách có hệ thống và phát hiện xu hướng trong tính chất của chúng. Sự phát triển liên tục của bảng tuần hoàn phản ánh những tiến bộ trong hiểu biết của chúng ta về các nguyên tố và vai trò trung tâm của chúng trong thế giới xung quanh chúng ta.
Phương pháp xây dựng bảng tuần hoàn
Sự sắp xếp có hệ thống của Mendeleev
Dmitri Mendeleev, một nhà hóa học người Nga, được cho là người tạo ra bảng tuần hoàn đầu tiên vào năm 1869. Ông sắp xếp các nguyên tố theo thứ tự khối lượng nguyên tử tăng dần, chừa chỗ cho các nguyên tố chưa được phát hiện. Ông cũng sắp xếp các nguyên tố sao cho các tính chất hóa học tương tự sẽ nằm trong cùng một hàng.
Khám phá của Moseley
Henry Moseley, một nhà vật lý người Anh, đã giúp cải thiện bảng tuần hoàn bằng cách sắp xếp các nguyên tố theo số hiệu nguyên tử thay vì khối lượng nguyên tử. Điều này giúp làm sáng tỏ một số điểm mơ hồ trong cấu trúc bảng tuần hoàn ban đầu của Mendeleev và giúp dự đoán các nguyên tố mới dễ dàng hơn.
Phát triển hiện đại
Bảng tuần hoàn ban đầu của Mendeleev đã trải qua nhiều cải tiến và sửa đổi của các nhà khoa học sau này. Bảng tuần hoàn hiện đại bao gồm các nguyên tố đã được phát hiện kể từ đó và chứa thông tin chi tiết hơn về các đặc tính của từng nguyên tố. Các phiên bản cập nhật của bảng được sử dụng rộng rãi trong cả hóa học và vật lý ngày nay.
Công nghệ và Bảng tuần hoàn
Với sự phát triển của công nghệ, việc nghiên cứu và phân tích các nguyên tố trong bảng tuần hoàn đã trở nên dễ dàng và chính xác hơn. Phần mềm và công cụ máy tính ngày nay cho phép các nhà khoa học dễ dàng truy cập và khám phá dữ liệu từ bảng tuần hoàn theo cách linh hoạt và hiệu quả.
Các đặc điểm chính của Bảng tuần hoàn các nguyên tố hóa học
Cấp bậc nguyên tố
Các hàng nguyên tố, còn được gọi là chu kỳ, là các đường ngang trên bảng tuần hoàn. Mỗi chu kỳ chạy từ kim loại kiềm thổ đến khí hiếm. Các nguyên tố trong cùng một chu kỳ thường có cùng lớp vỏ electron ngoài cùng.
Nhóm nguyên tố
Cột nguyên tố, còn được gọi là nhóm, là các cột dọc trên bảng tuần hoàn. Các nguyên tố trong cùng một nhóm thường có cùng số electron hóa trị và do đó có tính chất hóa học tương tự nhau.
Phân loại nguyên tố
Các nguyên tố được phân loại thành ba nhóm chính: kim loại, phi kim và khí hiếm. Kim loại là các nguyên tố có tính chất kim loại, phi kim là các nguyên tố không có tính chất kim loại và khí hiếm là các nguyên tố không phản ứng hoặc phản ứng rất ít với các nguyên tố khác.
Tính chất hóa học
Bảng tuần hoàn giúp xác định và dự đoán tính chất hóa học của các nguyên tố. Các nguyên tố trong cùng một nhóm thường có tính chất hóa học tương tự nhau do cùng cấu trúc electron hóa trị, trong khi các nguyên tố trong cùng một chu kỳ thường có tính chất hóa học khác nhau do cấu trúc electron khác nhau.
Phân Tích Chi Tiết Các Nhóm Và Chu Kỳ Trong Bảng Tuần Hoàn
Nhóm 1: Kim loại kiềm
Nhóm 1 của bảng tuần hoàn, còn được gọi là kim loại kiềm, bao gồm các nguyên tố như liti, natri và kali. Các nguyên tố trong nhóm này có một electron hóa trị và phản ứng rất mạnh với nước để tạo thành hydroxit kiềm.
| Yếu tố | Số nguyên tử | Loại nguyên tố |
|---|---|---|
| Liti | 3 | Kim loại |
| Natri | 11 | Kim loại |
| Kali | 19 | Kim loại |
- Đặc điểm chung của nhóm 1 là có một electron hóa trị ở lớp electron ngoài cùng.
- Kim loại kiềm thường mềm và có thể cắt bằng kéo.
- Tính chất hóa học hoạt động của nhóm 1 được thể hiện ở khả năng tạo thành các bazơ và hiđrua mạnh.
Nhóm 17: Halogen
Nhóm 17 của bảng tuần hoàn là nhóm halogen, bao gồm các nguyên tố flo, clo, brom và iốt. Các nguyên tố trong nhóm này có bảy electron hóa trị và thường tồn tại dưới dạng các phân tử hai nguyên tử.
- Flo (9), clo (17), brom (35) và iốt (53) chiếm nhóm 17 của bảng tuần hoàn.
- Halogen thường có mùi khá nồng và phản ứng mạnh với kim loại để tạo thành muối halide.
Giai đoạn 4: Lanthanide
Chu kỳ 4 của bảng tuần hoàn chứa các nguyên tố của dãy lanthanide, bao gồm lanthanum, xeri và erbi. Các nguyên tố này thường được sử dụng trong các ứng dụng công nghiệp và công nghệ cao.
- Danh sách các nguyên tố trong họ Lantan bao gồm Lantan, Xei, Praseodymi và Promethi.
- Các nguyên tố nhóm Lantan thường có hóa trị từ +2 đến +4.
Kết luận
Với chuỗi này, Mendeleev để lại những chỗ trống trong bảng của mình, dự đoán rằng chúng sẽ đại diện cho các nguyên tố chưa được khám phá. Dự đoán của Mendeleev sau đó đã được chứng minh là đúng.
Bảng tuần hoàn chắc chắn có tầm quan trọng trong lĩnh vực hóa học và vật lý. Sự sắp xếp các nguyên tố trong một hệ thống có cấu trúc đã giúp con người hiểu rõ hơn về thế giới xung quanh và tạo cơ sở cho sự phát triển của nhiều lĩnh vực khoa học khác nhau.
Mọi thắc mắc vui lòng gửi về Hotline 09633458xxx hoặc địa chỉ email [email protected] để làm rõ. Trân trọng!
Tuyên bố miễn trừ trách nhiệm: sesua.vn là website tổng hợp kiến thức từ nhiều nguồn,Vui lòng gửi email cho chúng tôi nếu có bất cứ vi phạm bản quyền nào! Xin cám ơn!














